Das Bronchialkarzinom (Lungenkarzinom, Lungenkrebs, engl.: lung carcinoma) ist eine bösartige Neubildung im Bereich der Atemwege. Es ist für 14% aller Todesfälle durch Krebs verantwortlich. Hauptursache ist Rauchen. Menschen mit einer genetischen Belastung sind besonders gefährdet. Hinsichtlich der Behandlung gibt es neue Entwicklungen.
→ Rauchen aufhören
→ Lungenkarzinom – Falldarstellung
Inhaltsverzeichnis
Das Wichtigste verständlich
| Kurzgefasst |
| Das Bronchialkarzinom, auch als Lungenkrebs bezeichnet, ist der häufigste Krebs und weiterhin mit einer besonders hohen Sterblichkeit (Mortalität) behaftet.
Es werden zwei Haupttypen unterschieden, der kleinzellige und der nicht kleinzellige Lungenkrebs (SCLC: small cell lung cancer; NSCLC: non small cell lung cancer). Der NSCLC ist mit 80-85% der weitaus häufigere Typ, wovon das Adenokarzinom der Lunge wieder am häufigsten vorkommt. Die Unterscheidung der Typen ist wegen der Wahl der geeigneten Therapie wichtig.  In den meisten Fällen (> 85 %) wird Lungenkrebs durch Rauchen ausgelöst. Auch eine genetische Veranlagung und Umwelteinflüsse, wie Asbest, Radon und Feinstaub, tragen zur Entstehung bei. Aspirin hat sich in Studien als vorbeugendes Prinzip herausgestellt. Eine Studie zeigt, dass die Einnahme von Aspirin (ASS, Acetylsalicylsäure) bei COPD-Patienten das Risiko um etwa 25% senkte. Die ersten Symptome, die zur Diagnostik veranlassen, sind meist Atemnot, Husten und blutiges Sputum (Hämoptoe). Die Diagnose wird geklärt durch Röntgenuntersuchungen und eine Spiegelung der Atemwege (Bronchoskopie) mit Gewinnung einer Gewebeprobe für eine feingewebliche Untersuchung (Histologie). Die Behandlung richtet sich nach Ausbreitung und Typ. wobei spezielle Tumormarker die Wahl der infrage kommenden Medikamente mitbestimmen. Eine Präzisionsmedizin, die sich auf die individuell aktiven wachstumsfördernden Signalwege richtet, begann mit der Einführung von Gefitinib, einem solchen Hemmstoff (Hemmung des EGFR-Signalwegs). Inzwischen sind weitere Neuentwicklungen hinzugekommen, die die Prognose weiter verbessern. Bei fortgeschrittenem Stadium (Stadium III und höher) liegt die 5-Jahresüberlebensrate bei 5 – 36 %. |
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Typen
- Kleinzeller: kleinzelliges Bronchialkarzinom (small cell lung cancer, SCLC),
- Nicht-Kleinzeller : großzelliges Bronchialkarzinom, z. B. Adenokarzinom (non-small cell lung cancer, NSCLC), Plattenepithekarzinome (etwa 30% der NSCLC), (1)Clin Chest Med. 2011 Dec; 32(4):669-92.
- andere, seltene Tumore.
Es werden je nach der Lage das zentrale und das periphere Bronchialkarzinom unterschieden.
Entstehung
Umweltfaktoren
- Zigarettenrauchen ist bei weitem die häufigste Ursache.
- Feinstaub z. B. durch den Straßenverkehr erhöht das Lungenkrebsrisiko (siehe hier).
- Karzinogene: Asbest, Arsen, Teerstoffe, radioaktive Substanzen, Radon (in Hauswänden).
Chronische Entzündungen und Umbauvorgänge
Lange bekannt ist das Narbenkarzinom z. B. nach einer Tuberkulose (meist ein Adenokarzinom).
Bakteriom der Bronchialschleimhaut
Bestimmte Bakterienstämme in der Lungenschleimhaut verändern das lokale Immunsystem und unterhalten Entzündungen. Über diesen Weg können sie Lungenkrebs auslösen. Bei Mäusen mit einer genetischen Krebsveranlagung (Kras-Mutation und p53-Verlust) lässt sich entsprechend die Krebsentstehung durch Antibiotika unterdrücken. (2)Cell. 2019 Jan 25. pii: S0092-8674(18)31654-4. doi: 10.1016/j.cell.2018.12.040.
Genetische Veranlagung
Eine genetische Veranlagung erhöht das Risiko von Lungenkrebs erheblich.
- Beim Kleinzeller (SCLC) finden sich Mutationen in den Tumorsuppressorgenen TP53 und RB1 sowie Veränderungen im Chromosom 3p und der Gene JAK2, FGFR1 und MYK. (3)Clin Lung Cancer. 2016 Sep;17(5):325-333. doi: 10.1016/j.cllc.2016.05.014. Epub 2016 Jun 8. PMID: … Continue reading
- Beim Adenokarzinom der Lunge (gehört zu den NSCLC) finden sich Mutationen von EGFR, KRAS, HER2 und BRAF. (4)Surg Today. 2018 Jan;48(1):1-8. doi: 10.1007/s00595-017-1497-7. Epub 2017 Mar 9. PMID: 28280984. Die bedeutendsten Onkogene entstammen Mutationen des KRAS-Gens. In einer Studie hatten 27% von 1655 Patienten mit Adenokarzinomen der Lunge eine solche Mutation. Ihr mittleres Überleben war tendenzmäßig kürzer als bei Patienten ohne eine solche-Mutation. (5)J Thorac Oncol. 2019 Feb 5. pii: S1556-0864(19)30097-8. doi: 10.1016/j.jtho.2019.01.020.
- Bei etwa 85 % der „Nichtkleinzeller“ (NSCLC) findet sich eine besonders starke Ausprägung eines Zellrezeptors, der das Wachstum anregt. Es handelt sich um den epidermalen Wachstumsfaktor-Rezeptor (EGFR), der bei einer bestimmten Mutation (del19 EGFR) besonders stark exprimiert (gebildet) wird. Wenn diese Mutation nachweisbar ist, können EGFR-Tyrosinkinasehemmer eine gute Behandlungsoption sein (s. u.). Mutationen im EGF-Rezeptor (Rezeptor des Epidermal Growth Factors, EGFR) an einer Stelle, die eine mit ihm verbundene Tyrosinkinaseaktivität kodiert (z.B. del19 EGFR) , können zu einer dauerhaften Aktivierung der Zellteilungsprozesse und damit zur Förderung des Tumorwachstums, der Metastasenbildung und der Blutversorgung des Tumors (Angiogenese) führen. Solch eine Mutation findet sich am häufigsten bei Adenokarzinomen und häufiger bei Frauen, bei asiatischen Patienten und bei Rauchern. Gefitinib, Afatinib, Erlotinib, Dacomitinib, Osimertinib, Icotinib und ähnliche Substanzen hemmen die EGFR-Aktivität und führen zu einer Lebensverlängerung bei fortgeschrittenem NSCLC. (6)Cochrane Database Syst Rev. 2021 Mar 18;3(3):CD010383. DOI: 10.1002/14651858.CD010383.pub3. (7)Curr Opin Oncol. 2015 Mar; 27(2):87-93. (8)Lancet Oncol. 2015 Feb; 16(2):141-51. Dazu siehe hier.
Genetische Signaturen
Die SCLCs werden laut ihren genetischen immunhistochemischen Signaturen in vier biologisch unterschiedliche Subtypen eingeteilt, nämlich SCLC-A, SCLC-N, SCLC-P und SCLC-I, was eine unterschiedliche Behandlung mit Checkpoint-Inhibitoren ermöglichen soll. (9)Cancers (Basel). 2022 Aug 3;14(15):3772. DOI: 10.3390/cancers14153772.
Zum Seitenanfang und Inhaltsverzeichnis
Symptome
- Appetitverlust,
- Gewichtsverlust bis hin zur Tumorkachexie,
- Husten,
- Hämoptyse (blutiges Sputum).
Begleiterkrankungen und Paraneoplasien
- Thrombosen, Thrombophlebitis saltans,
- Magenulkus,
- Hyperkalzämie-Syndrom,
- neuromuskuläre Störungen (Lambert-Eaton-Syndrom),
- IADH-Syndrom,
- Tumoranämie.
Der Tumor neigt dazu, paraneoplastische Symptome hervorzurufen. Zu ihnen gehören vor allem:
- Thrombophilie (Neigung zu Thrombose und Lungenembolie, häufig)
- Inappetenz und Gewichtsabnahme
- Lambert-Eaton-Syndrom mit Muskelschwäche (meist bei kleinzelligem Bronchialkarzinom, DD zu Myasthenia gravis)
- Hyperkalzämie-Syndrom (Erhöhung von PTH-Aktivität)
- Polyzythämie (durch Erythropoetin-ähnliche Substanz, beispielsweise beim Bronchialkarzinom
→ Zu Paraneoplasie siehe hier.
Komplikationen
Das Bronchialkarzinom kann selbst eine Reihe von Komplikationen auszulösen: Retentionspneumonie, Atelektase, Phrenikus- und Rekurrensparese mit Stimmveränderung, Hämoptoe (Blutsturz).
Metastasierung
Das Bronchialkarzinom metastasiert häufig in Knochen, Leber, Nebenniere und Gehirn.
Diagnostik
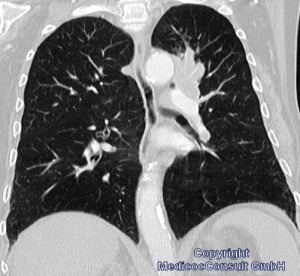
Die ersten Zeichen, die eine genauere Diagnostik veranlassen, sind meist Husten mit blutigen Schlieren im Schleim oder Bluthusten (Hämoptoe) und beginnende Atemnot. Daraufhin werden technische Untersuchungen indiziert:
- Röntgenbild der Lungen: Es findet meist bereits im herkömmlichen Röntgenbild sich eine „Verschattung“, die auf eine Raumforderung oder einen nicht beatmeten Lungenbezirk weist. Zur Diagnostik kleinerer Raumforderungen ist die Computertomographie geeigneter.
- Computertomographie des Brustraums (CT des Thorax): es lassen sich Raumforderungen abgrenzen und ihre Lage zu Blutgefäßen und Atemwege feststellen. Auch lassen sich Ausläufer in die Umgebung und Tochtergeschwülste (Metastasen) in der Nachbarschaft erkennen.
- Spiegelung der Atemwege (Bronchoskopie): Sie ermöglicht eine genaue Diagnose mit Einschätzung einer Blutungsbereitschaft und einer Verlegung der Atemwege und mit der Möglichkeit einer Gewebeprobenentnahme (Biopsie).
- Histologie: die Untersuchung der durch Biopsie gewonnenen Gewebeprobe unter dem Mikroskop (Histologie) ist für die Diagnostik des Tumortyps beweisend.
- Ausbreitungsdiagnostik: Um zu erkennen, ob der Tumor bereits zu Tochtergeschwülsten geführt hat, wird eine Ausbreitungsdiagnostik erforderlich. Metastasen werden oft in den Lungen, der Leber, im Knochen, in den Nebennieren und im Gehirn gefunden. Geeignete technische Untersuchungen sind die Sonographie des Abdomens, die Computertomographie des Thorax, des Abdomens und des Gehirns, die Skelettszintigraphie, ein PET-CT (sehr empfindlich, Diagnostik kleiner untypisch gelegener Herde möglich).
- Zellfreie DNA (cfDNA) und zirkulierende Tumorzellen (liquid biopsy) sind Marker für das Ansprechen einer Therapie eines SCLC. (10)Transl Lung Cancer Res. 2022 Oct;11(10):1995-2009. doi: 10.21037/tlcr-22-273. Auch im NSCLC lassen sich durch liquid biopsy prognostische Marker (EGFR-Mutationen) bestimmen, die eine Biopsie von Lungengewebe ersetzen und bei der Wahl einer Therapie helfen können. (11)Front Oncol. 2020 Oct 8;10:572895. doi: 10.3389/fonc.2020.572895
Prognostische Faktoren
Der systemische Immunentzündungsindex (SII) ist ein Index, der auf der Anzahl der peripheren Blutplättchen, Neutrophilen und Lymphozyten beruht.
- SII = Thrombozytenzahl × Neutrophile/Lymphozyten.
SII reflektiert das Gleichgewicht zwischen Entzündungsreaktion und Immunantwort. Er stellt einen Biomarker für verschiedene Tumore inkl. für das NSCLC dar. Patienten mit einem hohen Immunentzündungsindex (SII) haben ein schlechteres progressionsfreies und Gesamtüberleben. (12)J Clin Lab Anal. 2019 Oct;33(8):e22964. doi: 10.1002/jcla.22964 (13)Int J Environ Res Public Health. 2020 Oct 30;17(21):7995. DOI: 10.3390/ijerph17217995
Zum Seitenanfang und Inhaltsverzeichnis
Therapie
Die Behandlung des Bronchialkarzinoms unterscheidet sich je nach vorliegender Histologie und nachweisbaren Onkogenen.
Kleinzeller (SCLC)
Nur in wenigen Fällen kann nach Diagnosestellung noch mit kurativer Absicht operiert werden. Infrage kommt häufig alleine eine Chemo-Radiotherapie. Der therapeutische Erfolg kann durch zusätzliche Antikörper verbessert werden. So wird in fortgeschrittenem Stadium vielfach die Kombination Platin-Etoposid plus Atezolizumab oder Durvalumab verwendet. (14)Lung. 2021 Dec;199(6):579-587. DOI: 10.1007/s00408-021-00486-y
Nichtkleinzeller (NSCLC)
Prinzipiell stehen für diesen Typ drei Therapieoptionen zur Verfügung: Operation, Strahlentherapie, Chemotherapie und Immuntherapie. (15)Semin Cancer Biol. (2018) 52(Pt 1):103–9
Beim Adenokarzinom brachte eine Chemotherapie bisher nur unbefriedigende Erfolge. Verwendet werden häufig Gemcitabine, Vinorelbine, Paclitaxel und Docetaxel in Kombination mit Cisplatin. (16)Crit Rev Oncol Hematol. 2012 Dec;84(3):340-9.
Beim Epithelzellkarzinom wird häufig eine Carboplatin– und Paclitaxel-basierte Chemotherapie mit Cetuximab verwendet. Bei EGFR-FISH-positiven Krebsarten allerdings lag das mittlere Überleben unter zusätzlich Cetuximab bei 11,8 Monaten (vs. 6,1). (17)Lancet Oncol. 2018 Jan; 19(1): 101–114. doi: 10.1016/S1470-2045(17)30694-0
Inzwischen werden mit einer Anti-EGFR-Behandlung und ALK-Hemmern (Tyrosinkinase-Hemmern) weitere Fortschritte erzielt.
→ Zur Therapie des Bronchialkarzinoms siehe hier.
Zum Seitenanfang und Inhaltsverzeichnis
Vorbeugung und Überwachung
Die wirksamste Vorbeugung des Bronchialkarzinoms ist ein Verzicht auf Rauchen.
Aspirin hat sich in Studien als vorbeugendes Prinzip herausgestellt. Eine Studie zeigt, dass die Einnahme von Aspirin (ASS, Azetylsalizylsäure) das Risiko um etwa 25% senkte. In der Studiengruppe bekam statistisch je 125 Patienten mit COPD (einer chronischen Lungenkrankheit), die über 5 Jahre ASS bekommen haben, einer weniger ein Lungenkarzinom. Nebenwirkungen waren vermehrtes Bluthusten, nicht aber ein erhöhtes Gesamtrisiko für Magen-Darm-Blutungen. (18)PLoS Med. 2022 Jan 13;19(1):e1003880. DOI: 10.1371/journal.pmed.1003880. PMID: 35025879; PMCID: … Continue reading
LDCT-Screening
Bei starkem Rauchen und familiärer Häufung von Bronchialkarzinomen ist eine intensive Vorbeugung indiziert. Eine Vorsorge durch LDCT-Screening (low-dose computed tomography) vermag bei ihnen die Lungenkrebsmortalität und die Gesamtmortalität bedeutend zu reduzieren. (19)Prev Med. 2016 Aug;89:301-314. DOI: 10.1016/j.ypmed.2016.04.015 In den USA wird empfohlen, dass starke Raucher (Raucheranamnese von 20 Packyears) im Alter von 50 bis 80 Jahren ein jährliches Screening auf Lungenkrebs durchführen lassen sollten, sofern sie nicht innerhalb der letzten 15 Jahre damit aufgehört haben. (20)JAMA. 2021 Mar 9;325(10):962-970. DOI: 10.1001/jama.2021.1117
Überwachung und Frühdiagnose
Exosome im Blut, die aus Tumorzellen stammen, können diagnostisch wertvolle Biomarker beinhalten. Sie lassen sich in einer Blutprobe prüfen (liquid biopsy). Die Serumexosome miR-128-3p und miR-33a-5p eignen sich laut einer Untersuchung als Biomarker für ein groß angelegtes NSCLC-Screening. (21)J Thorac Dis. 2023 May 30;15(5):2616-2626. DOI: 10.21037/jtd-23-398
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
- Lungenkarzinom – Falldarstellung
- Tumorerkrankungen
- Paraneoplasie
- Inappetenz
- Husten
- Immuntherapie von Krebs
Patienteninfos
Zum Seitenanfang und Inhaltsverzeichnis
[vc_wp_search]
Literatur