Inhaltsverzeichnis
Allgemeines
Die Porphyria cutanea tarda (PCT), früher auch als chronische hepatische Porphyrie bezeichnet, ist die häufigste Porphyrieform beim Menschen. Sie ist eine photoreaktive Hauterkrankung, die durch die Hemmung oder einen genetischen Defekt des Häm-Biosynthese-Enzyms Uroporphyrinogen-Decarboxylase (UROD) in der Leber verursacht wird.

Zwei Hauptformen werden unterschieden:
- eine sporadische Form (Typ-I-PCT) und
- eine familiäre Form (Typ-II-PCT).
Beide haben eine verminderte UROD-Aktivität in der Leber zur Voraussetzung, beide werden auch durch Umweltfaktoren getriggert.
Die PCT ist charakterisiert durch bullöse Hautläsionen und eine massive Ausscheidung von Uroporphyrin mit dem Urin. Eine Leberschädigung kommt vor, ist aber unterschiedlich ausgeprägt. Ihr Ausmaß ist abhängig von zusätzlichen pathogenetischen Faktoren, zu denen Alkohol, Rauchen, Östrogene und das Hämochromatose-Gen gehören.
Inzidenz
Die PCT ist unter den seltenen Stoffwechselkrankheiten relativ häufig; die Inzidenz liegt bei 1 auf 10000. Das Hauptmanifestationsalter liegt jenseits von 50 Jahren. Männer sind geringfügig häufiger betroffen als Frauen.
Entstehung
Sowohl genetische als auch Umweltfaktoren spielen bei der Entwicklung einer symptomatischen Porphyria cutanea tarda zusammen.
Porphyrine sind Zwischenprodukte in der Synthese von Häm, einem Eisen-haltigen Molekül, das für die Funktion des Hämoglobins und vieler Cytochrome erforderlich ist. Die Aktivität der Uroporphyrinogen-Decarboxylase (UROD), des 5. Enzyms in der Hämsynthese, ist bei der PCT auf unter 20% vermindert. Dieses Enzym katalysiert die Umwandlung von Uroporphyrinogen zu Coproporphyrinogen. Inzwischen sind mindestens 13 Mutationen der UROD bekannt.
Im Zytosol von Leberzellen wurde ein UROD-Inhibitor gefunden, der bei der Pathogenese der PCT eine Rolle spielt.
Durch die Abnahme der Enzymaktivität sammelt sich Uroporphyrin (das Oxidationsprodukt von Uroporphyrinogen) in der Leber an und gelangt über die Blutbahn zur Haut. (1)Mol Genet Metab. 2019 Jan 18. pii: S1096-7192(18)30579-1. doi: 10.1016/j.ymgme.2019.01.004. (2)Best Pract Res Clin Gastroenterol. 2010 Oct;24(5):735-45. doi: 10.1016/j.bpg.2010.07.002.
Formen der PTC
- Die sporadische bzw. erworbene Form (Typ I) wird durch Alkohol, Rauchen, Hepatitis C, HIV, Lupus erythematodes, Östrogene, Medikamente und verschiedene Chemikalien ausgelöst. (3)Mol Genet Metab. 2019 Jan 18. pii: S1096-7192(18)30579-1. doi: 10.1016/j.ymgme.2019.01.004. (4)Am J Case Rep. 2014 Jan 21;15:35-40. doi: 10.12659/AJCR.889955. eCollection 2014.
- Die hereditäre Form (Typ II) ist durch das Auftreten von PCT-Fällen in der Familie gekennzeichnet; oft lässt sich lediglich eine erhöhte Sonnenempfindlichkeit in der Familienanamnese eruieren. Es sind inzwischen eine Reihe von Genen bekannt, deren Mutation diese Form auslösen. (5)Mol Genet Metab. 2018 Nov 28. pii: S1096-7192(18)30642-5. doi: 10.1016/j.ymgme.2018.11.013.
- Tritt die PCT in der Familien sporadisch auf, wird sie als Typ III bezeichnet.
- Selten liegt ein homozygoter UROD-Defekt vor, die als Typ IV bezeichnet wird und bereits in der Kindheit zu Symptomen führt.
Reaktionen in der Haut
Uroporphyrin der Haut wird durch langwelliges uv-Licht aktiviert; es entstehen reaktive Sauerstoffspezies, die an den belichteten Arealen zu einer oxidativen Schädigung mit bullösen Hautveränderungen (Blasenbildungen) führen.
Reaktionen in der Leber
Uroporphyrinogen, das Substrat der UROD, wird zu Uroporphyrin oxidiert und sammelt sich in der Leber an. Es führt zu einer Leberzellschädigung, deren Ausprägung sehr unterschiedlich sein kann. Wenn individuelle Faktoren, die die Reaktionsbereitschaft der Leber erhöhen, hinzukommen, kann es zu schweren Leberschäden kommen.
Faktoren, die die Leberempfindlichkeit erhöhen
Faktoren, die für eine akute Symptomatik empfänglich machen, (Suszeptibilitätsfaktoren) sind einer Studie zufolge Alkoholgenuss (87 %), Rauchen (81 %), chronische Hepatitis C (69 %) und Mutation des HFE-Gens (53 %). (6)Clin Gastroenterol Hepatol. 2010 March; 8(3): 297–302.e1
- Eisengehalt der Leber: Alkoholkonsum, eine chronische Hepatitis C und das HFE-Gen senken die Aktivität von Hepcidin, erhöhen die Eisenresorption im Darm und steigern den Eisengehalt der Leber. (7)Liver Int. 2012 Jul;32(6):880-93 Eisen ist neben CYP1A2 (s. u.) ein essentieller Faktor in der Pathogenese der PTC: in Eisen-defizienten Mäusen entwickelt sich unter Induktionsbedingungen keine Porphyrie. (8)Biometals. 2009 Apr;22(2):345-51 Eine der PTC-induzierenden Funktionen des Eisens scheint darin zu liegen, dass es die Oxidation von Uroporphyrinogen zu Uroporphomethen fördert, was UROD kompetitiv hemmt. (9)Proc Natl Acad Sci U S A. 2007 March 20; 104(12): 5079–5084 Die Eisenabhängigkeit der PTC-Entwicklung hat erhebliche therapeutische Bedeutung (s.u.).
- Oxidativer Stress der Hepatozyten (Leberzellen): Alkokol, Hepatitis C und Östrogene erhöhen die Produktion reaktiver Sauerstoffspezies in den Zellen.
- Cytochrom 1A2: Rauchen und Alkohol induzieren Cytochrom-P450-Enzyme, so auch CYP1A2. Dieses Cytochrom ist wesentlich für die Entstehung einer Uroporphyrie im Mausmodell; seine Abwesenheit (in Knock-out-Mäusen) schützt vor der lebertoxischen Wirkung des Uroporphyrins. (10)Toxicol Appl Pharmacol. 2001 Jun 1;173(2):89-98 Bei PTC-Patienten wurden zwei Allele identifiziert (CYP1A2*1F und GSTM1, g-163A), die mit der Entwicklung einer PTC assoziiert sind. (11)Mol Med. 2011 Mar-Apr; 17(3-4): 241–247 In einer französischen Studie spielte der CYP1A2-Genotyp jedoch keine Rolle bei PCT-Patienten. (12)Br J Dermatol. 2012 Feb;166(2):425-9. doi: 10.1111/j.1365-2133.2011.10642.x
- Antikörper gegen ein zytosolisches Leberprotein (40000 kDa) werden gehäuft bei der Hepatitis-C-assoziierten PCT gefunden. (13)Clin Exp Immunol. 2001 October; 126(1): 47–53
Symptomatik
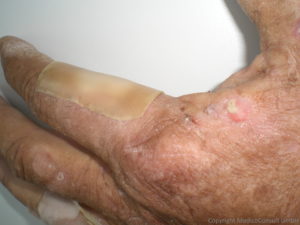
Hautmanifestationen: Die Symptomatik der Porphyria cutanea tarda wird durch die bullösen Hautläsionen an sonnenexponierten Stellen des Körpers bestimmt. Oft lässt sich eine vermehrte Behaarung des Körpers und des Gesichts erkennen. Die Haut ist oft vermehrt vulnerabel und elastisch. Bei beiden PCT-Typen (I und II) hängen die Hauterscheinungen von zusätzlichen Faktoren ab, die die UROD zusätzlich in ihrer Aktivität hemmen. (14)Mol Genet Metab. 2018 Nov 28. pii: S1096-7192(18)30642-5. doi: 10.1016/j.ymgme.2018.11.013.
Lebersymptome: Klinische Zeichen einer chronischen Lebererkrankung mit Cholestase und Entwicklung einer Leberzirrhose treten nur sporadisch auf.
-
Diagnostik
Die Diagnose einer Porphyria cutanea tarda gerät durch die typischen bullösen Hautläsionen (Blasenbildungen), die Abheilungsnarben an lichtexponierten Stellen des Körpers und Hyperpigmentationen ins Blickfeld. Auch andere Porphyrie-Typen verursachen solche Hautläsionen, so auch die hereditäre Koproporphyrie und die Porphyria varegata. Diese Typen weisen jedoch im Urin einhöhte Werte für Delta-Aminolävolinsäure und Prophobilinogen auf, was bei der PCT nicht der Fall ist. Im Urin der PCT dagegen finden sich große Mengen an Uroporphyrin (unter der uv-Lampe rot fluoreszierend), jedoch kein Porphobilinogen und D-ALA.
UROD- und HFE-Genanalyse können zur Diagnostik beitragen. Eine Mutation in diesen Genen ist jedoch nicht Voraussetzung für die Diagnose. In einem großen Teil der Fälle liegt eine Hemmung der normalen (genetisch nicht mutierten) UROD vor.
Therapie
Grundlage jeder PCT-Therapie ist die strikte Vermeidung auslösender Faktoren wie Alkohol, Rauchen, Östrogenen und auslösenden Medikamenten. Am besten wirken
- wiederholte Aderlässe zur Entfernung vermehrten Körpereisens bis zur Anämiegrenze sowie
- Chloroquin zur Steigerung der Porphyrinausscheidung. (15)Liver Int. 2012 Jul;32(6):880-93 (16)Mol Genet Metab. 2019 Jan 18. pii: S1096-7192(18)30579-1. doi: 10.1016/j.ymgme.2019.01.004.
→ Bezüglich unsicherer und sicherer Medikamente siehe Liste hier.
Bei Niereninsuffizienz– und Dialyse-assoziierter PCT ist Chloroquin wirkungslos. Kleine wiederholte Aderlässe unter Erythropoetin-Gabe oder Desferrioxamin werden empfohlen. (17)Expert Opin Pharmacother. 2005 Mar;6(3):377-83
Eine Therapie der Hepatitis C vermag einen PCT-Schub auszulösen. Sie können mit Hydroxychloroquin effektiv behandelt werden. Die neuen DAA’s führen laut einer Zusammenstellung nicht zu einer Schubauslösung. (18)Am J Med Sci. 2017 Jun;353(6):523-528. doi: 10.1016/j.amjms.2017.03.007.
Risiken und Prognose
Die PCT bedeutet für die Betroffenen ein erhöhtes Risiko für Leberkrebs (HCC, etwa 20-fach), Gallenwegskrebs (cholangioläres Karzinom, CCC) und Gallenblasenkrebs (etwa 7-fach) sowie für einen vorzeitigen Tod (1,5-fach). Ein Teil des Risikos mag einem ungesunden Lebensstil zuzuschreiben sein (vor allem Alkoholabusus und Rauchen), ein Teil wird aber auch der Grunderkrankung zugeordnet. (19)Orphanet J Rare Dis. 2019 Apr 3;14(1):77. doi: 10.1186/s13023-019-1051-3.
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Literatur