Das Harnblasenkarzinom (engl.: bladder cancer, meist kurz: Blasenkarzinom) ist weltweit der zehnt häufigste Krebs; es gehört zu den Urothelkarzinomen (Krebs der Harnwege).
Inhaltsverzeichnis
Das Wichtigste verständlich
| Kurzgefasst |
| Das Harnblasenkarzinom gehört zu den prinzipiell früh diagnostizierbaren Tumoren. Erster Hinweis sind Mikroblutungen, die durch eine routinemäßige Urinuntersuchung auffallen; der Urin-Teststreifen ist bezüglich Blut positiv. Durch neue Entwicklungen wird eine Diagnose über Bestimmung bestimmter MikroRNA weitaus früher möglich.
Wenn der Urintest bezüglich Blut positiv ausfällt und die Nieren nicht als Ursache infrage kommen, wird die Blase untersucht. Die Diagnostik beinhaltet eine Blasenspiegelung mit Entnahme von Gewebeproben. In etwa 70 % aller neu entdeckten Fälle von Blasenkrebs liegt noch ein Frühstadium vor, in dem der Tumor auf die Schleimhaut begrenzt ist und noch nicht invasiv wächst. Im Frühstadium kann Blasenkrebs durch Resektion (endoskopisch durch die Harnröhre, TUR) geheilt werden. Bei nicht ausreichend resezierbarem Befund kommt eine Chemotherapie in Betracht. Die adjuvante Therapie mit BCG-Installation in die Blase vermindert das Risiko eines Neuauftretens. (1)Singapore Med J. 2022 Jun;63(6):325-329 Heute erweitern Biologika das Therapiespektrum. (2)Med Sci (Basel). 2018 Dec 7;6(4). pii: E113. doi: 10.3390/medsci6040113. |
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Epidemiologie
Der Altersgipfel liegt zwischen 50 und 75 Jahren. Männer sind dreimal häufiger als Frauen betroffen.
Entstehung
Vorstufe des Harnblasenkarzinoms ist eine Dysplasie (Fehlbildung) von Basalzellen, aus denen krebsartige Zellen entstehen.
Chronische Harnblaseninfektionen mit Leukoplakien gehen mit einem erhöhtem Krebsrisiko einher. Sind Krebszellen entstanden und werden sie vom Abwehrsystem des Körpers nicht gleich eliminiert, beginnen sie sich unkontrolliert zu vermehren.
Fördernde Faktoren: Die Entstehung wird durch chemische Giftstoffe begünstigt, wie Amine und Nitrosamine, Anilin-Derivate, Tryptophan und Inhaltsstoffen von Zigarettenrauch. Raucher tragen daher ein erhöhtes Risiko. Ein erhöhtes Risiko entsteht auch durch eine Berufsexposition in der chemischen Industrie, im Bergbau, in der Aluminium- und Textilindustrie etc. (3)Nurse Pract. 2017 Mar 7;42(3):26-33.
Annexin A1 und A2 (AnxA2) spielen bei der Ausbreitung eine besondere Rolle: Es ist ein Ca++-abhängiges Phospholipid-bindendes Protein, das im Tumor überexprimiert wird und die Migration (Auswanderung) entarteter Zellen erleichtert. Die Annexine können möglicherweise Biomarker und therapeutisches Ziele für das invasive Blasenkarzinom darstellen. (4)Cancer Cell Int. 2022 Jan 6;22(1):7. doi: 10.1186/s12935-021-02427-4 (5)Cancers (Basel). 2022 Nov 18;14(22):5664. doi: 10.3390/cancers14225664
MikroRNA: MikroRNA spielen auf molekularbiologischer Ebene eine vermittelnde Rolle. miR-200a-3p beispielsweise ist hochreguliert (überexprimiert) und stellt (über eine Downregulation von A20) für den Blasenkrebs ein hypothetisches Onkogen dar. (6)Transl Androl Urol. 2021 Nov;10(11):4262-4274. DOI: 10.21037/tau-21-941 Der Spiegel an mir-200a-3p im Urin war in einer Untersuchung mit der Prognose von Blasenkrebs assoziiert. (7)Cancers (Basel) 2020;12:3133. 10.3390/cancers12113133 DOI: 10.3390/cancers12113133
Zum Seitenanfang und Inhaltsverzeichnis
Symptomatik
Das Harnblasenkarzinom macht in Frühstadien keine Symptome. Dennoch kann es durch regelmäßige Urinuntersuchungen bei älteren Menschen erkannt werden. Eine Mikroblutung ist zwar nicht subjektiv erkennbar, wird aber durch einen Urinstix unkompliziert und sehr sensitiv schon lange vor einer subjektiven Symptomatik angezeigt.
Typisches Erstsymptom: schmerzlose Makrohämaturie oder Materialabgang im Urin. Dysurie und Pollakisurie entstehen meist erst bei größeren Tumoren.
Im Spätstadium entstehen folgende Symptome: Gewichtsabnahme, Anämie, u.U. Flankenschmerzen als Hinweis auf eine komplizierende aufsteigende Harnwegsinfektion, Entwicklung einer Pyelonephritis, bei Verlegung der Ureteren (Harnleiter) Harnstau mit Niereninsuffizienz und ihren Symptomen.
Histologie
Das Harnblasenkarzinom wird unterteilt in:
- Urothelkarzinom: G1-3 (ca. 95%): > 6 Zellschichten; ein Papillom (G0) dagegen hat < 6 Zellschichten und gilt als noch benigne,
- Plattenepithel-, Adenokarzinome (ca. 5%).
Oft wächst das Harnblasenkarzinom schnell infiltrierend, durchsetzt den M. detrusor vesicae und metastasiert in iliakale Lymphknoten (und Fossa obturatoria).
Die Tumoren sind in ca. 50% multilokulär und ca. zu 70% an der Blasenhinterwand lokalisiert.
Zum Seitenanfang und Inhaltsverzeichnis
Diagnostik
Das Harnblasenkarzinom gehört zu den früh erkennbaren Tumoren. Wichtig ist eine regelmäßige Vorsorge älterer Menschen durch Urinuntersuchungen.
Blut im Urin ohne sonstige Symptome wie Brennen beim Wasserlassen oder Nierenschmerzen veranlasst eine genauere Untersuchung bezüglich Krebs im Urogenitaltrakt. Wenn die Nieren als Ursache nicht im Vordergrund stehen, ist vor allem bei älteren Menschen ein Blasentumor eine der wichtigen Differenzialdiagnosen.
- Die Zytologie aus Urinsediment (Harnzytologie) kann zur Früherkennung und Verlaufskontrolle (abgeschilferte Tumorzellen) verwendet werden.
- Die Bestimmung von miRNA im Blut und im Urin scheint zur Diagnostik und Prognostik des invasiven Blasenkarzinoms wertvoll werden zu können. (8)Med Sci Monit. 2019 May 9;25:3425-3434. doi: 10.12659/MSM.916697. (9)Int J Mol Sci. 2020 May 27;21(11):3814. DOI: 10.3390/ijms21113814.
- Eine bimanuelle rektale Untersuchung kann bei größeren Tumoren die lokale Infiltration beurteilen lassen.
-
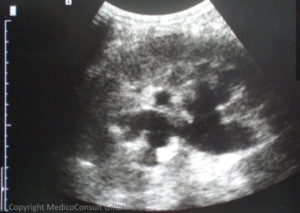
Nierenstauung durch Abflussstörung des Harnleiters bei Blasenkrebs Die Ultraschalluntersuchung (Sonographie) ermöglicht den Nachweis einer Raumforderung in der Blasenwand und ggf. eines infiltrativen Wachstums; auch eine rektale Sonographie kann dazu beitragen. Die Ultraschalluntersuchung der Nieren dient dem Ausschluss eines Nierenprozesses sowie dem Nachweis eines eventuellen Harnstaus durch Verlegung einer Harnleitermündung (meist einseitig).
- Ein radiologisches Ausscheidungsurogramm dient ebenfalls dem Nachweis einer Nierenstauung, wird aber wegen der Aussagekraft der Sonographie und des in fortgeschrittenem Stadium notwendigem CT kaum noch zusätzlich erforderlich.
- Eine CT und MRT (Computertomographie oder Magnetresonanztomographie) ist indiziert, wenn zystoskopisch vermutet werden muss, dass der Tumor invasiv wächst. Sie ermöglichen einen Nachweis invasiven Wachstums, der Organüberschreitung, eines Lymphknotenbefalls und von Fernmetastasen.
- Die Blasenspiegelung (Urethrozystoskopie) mit Quadrantenbiopsie erbringt einen definitiven Nachweis eines Tumors und ermöglicht durch eine Biopsie eine mikroskopische Untersuchung, die wiederum ergibt, ob der Tumor die Schleimhaut definitiv überschreitet oder lokal geblieben ist. Sie ist zu Diagnosesicherung oder -ausschluss in praktisch jedem Fall erforderlich.
Differenzialdiagnosen
Differentialdiagnostisch kommen in Betracht:
- bei Nachweis von Blut im Urin und Dysurie: eine hämorrhagische Zystitis (Blasenentzündung), Urolithiasis (Harnsteine), Fisteln bei Morbus Crohn und ein in die Blase eingebrochenes kolorektales Karzinom.
- ohne weitere Symptomatik: ein Urothelkarzinom.
Zum Seitenanfang und Inhaltsverzeichnis
Therapie
Die Behandlung erfolgt abhängig von der Eindringtiefe des Tumors und dem Allgemeinzustand des Patienten nach Leitlinien. (10)J Natl Compr Canc Netw. 2022 Aug;20(8):866-878. doi: 10.6004/jnccn.2022.0041
Etwa 75–80% der Blasenkarzinome werden in einem Stadium entdeckt, in dem eine zystoskopische transurethrale Resektion des Blasentumors noch möglich ist. Der entfernte Tumor wird mikroskopisch untersucht, speziell auf eine eventuelle Überschreitung der Tumorausbreitung über die Schleimhaut hinaus in die Tiefe der darunterliegenden Muskulatur der Blase. Anschließend wird je nach Risiko eine Chemotherapie angeschlossen. Die Nachkontrolle erfolgt über längere Zeit zystoskopisch. (11)BJU Int. 2017 Dec;120(6):755-765. doi: 10.1111/bju.14045.
Therapie bei lokalem Karzinom (NMIBC)
Bei einem lokoregionären Tumor (carcinoma in situ), der noch nicht die Schleimhaut überschritten hat (non‐muscle‐invasive bladder cancer, NMIBC), kommt nach einer lokalen Resektion durch das Zystoskop (TUR) eine Chemotherapie in Betracht sowie eine zystoskopische Nachsorge nach 3, 9 und 18 Monaten und danach einmal pro Jahr. Mitomycin C, Epirubicin und Doxorubicin haben alle positive Wirkungen gezeigt. (12)Journal of Urology 2004;171(6 Pt 1):2186‐90 Ein Relaps (Wiederauftreten und Fortschreiten) ist jedoch nicht allzu selten. Es wurde nachgewiesen, dass intravesikaler Bacillus Calmette-Guérin (BCG) einen Relaps reduziert. (13)Eur Urol. 2010 Mar;57(3):410-29. doi: 10.1016/j.eururo.2009.11.023 Die intravesikale BCG-Therapie vermittelt eine lokale gegen den Tumor gerichtete Immunantwort in der Blase. (14)J Urol. 1990;144:53–8 Sie ist gut verträglich und die standardmäßige adjuvante Behandlung des nicht-muskelinvasiven Blasenkarzinoms. (15)Singapore Med J. 2022 Jun;63(6):325-329. doi: 10.11622/smedj.2020168
Bei einem erhöhten Rezidivrisiko ist eine Basenentfernung (operative Zystektomie) zu diskutieren.
Therapie bei lokal fortgeschrittenem oder metastasiertem Karzinom
Wenn der Tumor die Schleimhaut der Blase überschreitet und bereits in die darunterliegende Muskelschicht (Muscularis) eindringt, kommen je nach Befund eine Chemotherapie, Zystektomie oder Strahlentherapie in Betracht.
- Sollte der Krebs auf die Blase beschränkt geblieben sein, kann auch in diesem Stadium noch eine Heilung erzielt werden. Meist wird ein Cisplatin-Kombinationsschema als neoadjuvante Behandlung vor radikaler Zystektomie oder radikaler Strahlentherapie angeboten.
- Wenn der Blasenkrebs das Organ überschritten hat und wenn bereits Lymphknoten oder Fernmetastasen aufgetreten sind, bleibt i.d.R. nur eine systemische Chemotherapie als Option übrig.
Medikamentöse Therapie
Zur medikamentösen Behandlung bei operativ nicht oder nicht ausreichend therapierbaren Stadien kommt eine herkömmliche Chemotherapie auf der Basis von Cisplatin in Betracht.
Chemotherapie
Die Cisplatin-basierte Kombinationschemotherapie des metastasierenden Harnblasenkarzinoms ist die einzige Therapie, die bisher nachweislich das Überleben in der First-Line-Situation verbessern konnte. Zu den üblicherweise verwendeten Kombinationen gehören
- MVAC (Methotrexat, Vinblastin, Doxorubicin und Cisplatin) und
- GC (Gemcitabin und Cisplatin).
Diese Therapien ermöglichen bei einem metastasierenden Blasenkarzinom ein progressionsfreies Überleben von etwa 8 Monaten bei einer Ansprechrate von annähernd 50%. Das mittlere Überleben liegt bei 14-15 Monaten. (16)Ther Adv Urol. 2019 Apr 4;11:1756287219839285. doi: 10.1177/1756287219839285.
Therapie mit Biologika
Heute wird das Spektrum durch Immun-Checkpoint-Hemmer (ICIs) erweitert. Sie sind gegen das Apoptose– (programmierte Zelltod)-Protein 1 (PD-1) oder dessen Liganden gerichtet (Anti-PD-1 ICIs). Ihr Einsatz hat zur Verbesserung des Überlebens geführt. Als Medikamente kommen Atezolizumab und Pembrolizumab in Betracht. Sie werden zur Zweitlinienbehandlung oder bei Kontraindikation gegen Platin auch als Erstlinientherapie eingesetzt. (17)Cancer Treat Rev. 2019 Jun;76:10-21. doi: 10.1016/j.ctrv.2019.04.002. (18)Ther Adv Urol. 2019 Apr 4;11:1756287219839285. doi: 10.1177/1756287219839285. (19)Oncologist. 2019 Apr;24(4):563-569. doi: 10.1634/theoncologist.2018-0084.
Pembrolizumab: In einer Studie zur Wirksamkeit von Pembrolizumab (ein Immuncheckpoint-Inhibtor, der Tumorzellen für das Immunsystem erkennbar macht) lag das mittlere Überleben in der Pembrolizumab-Gruppe 10,3 Monate versus 7,4 Monaten in der Chemotherapiegruppe. Nach 12 Monaten lebten noch 43,9% der Patienten in der Pembrolizumab-Gruppe gegenüber 30,7% in der Chemotherapiegruppe. (20)N Engl J Med. 2017 Mar 16;376(11):1015-1026. doi: 10.1056/NEJMoa1613683. In Kombination mit Disitamab Vedotin (RC48, ein Antikörper-Medikamenten-Addukt gegen den Wachstumsfaktor HER) scheint die Wirkung noch erheblich höher zu sein. (21)Front Immunol. 2022 Nov 15;13:978266. DOI: 10.3389/fimmu.2022.978266
Erdafitinib: Auch Erdafitinib, ein Pan-FGFR-Hemmer, kommt heute für Platin-vorbehandelte fortgeschrittene metastatische Blasenkarzinome, die genetische Veränderungen von FGFR3 oder FGFR2 aufweisen, in Betracht, ebenso Enfortumab vedotin, ein Antikörper-Medikamenten-Konjugat (22)Cancer Treat Rev. 2019 Jun;76:10-21. doi: 10.1016/j.ctrv.2019.04.002. Inoperabler Blasenkrebs (allgemein das Urothelkarzinom), der nicht mehr auf Chemotherapie anspricht, reagierte in einer Studie in 40% auf den Tyrosinkinasehemmer Erdafitinib. Voraussetzung war der Nachweis einer genetischen Veränderung des Wachstumsfaktors für Bindegewebszellen (FGFR-Mutation) im Tumor. Die Lebenszeit betrug darunter im Mittel 13,8 Monate, davon waren 5,5 sogar progressionsfrei. 13% brachen die Therapie wegen Nebenwirkungen ab. (23)N Engl J Med 2019; 381:338-348 DOI: 10.1056/NEJMoa1817323 In einer weiteren Studie zeigte sich, dass das mittlere das mittlere progressionsfreie Überleben unter Erdafitinib länger als unter Chemotherapie war (5,6 Monate vs. 2,7 Monate), das mittlere Gesamtüberleben war ebenfalls deutlich länger (12,1 Monate vs. 7,8 Monate). (24)N Engl J Med 2023; 389:1961-1971, DOI: 10.1056/NEJMoa2308849
Perspektive: Anexin-Downregulation: In Tierexperimenten führte die Herunterregulierung von AnxA2-Zellen zu einer signifikanten Hemmung der Migration und Invasion der Krebszellen (s. o.). Anexin scheint ein vielversprechendes therapeutisches Ziel für fortgeschrittenen Blasenkrebs sein zu können. (25)Cancers (Basel). 2022 Nov 18;14(22):5664. DOI: 10.3390/cancers14225664
Elektroresektion
Nur bei oberflächlich wachsenden Tumoren (TNM-Klassifikation: Tis (Carcinoma in situ), Ta (nichtinvasiver papillärer Tumor), T1 G1-2 (Infiltration des subepithelialen Bindegewebes mit guter Differenzierung der Krebszellen).
Dabei werden tumoröse Blasenanteile elektrisch abgeschält und jeweils histologisch untersucht, um beurteilen zu können, ob das Geschwulst in toto entfernt werden konnte. Komplikationen: Nachblutungen, Blasenperforation (dann Laparotomie mit Übernähung), Harnwegsinfektionen.
Zystektomie
Bei tiefer infiltrierenden Tumoren (T2-4).
Beim Mann: Entfernung der Blase, der Samenbläschen und der Prostata
Bei der Frau: Entfernung der Blase und des Uterus
In beiden Fällen resultiert Impotenz bzw. Unfruchtbarkeit.
Die Operation kann mit kontinenter (z.B. Ureterosigmoideostomie, Ileum-Neoblase etc.) und inkontinenter (Ureterodermale Fistel, Ileum-Conduit etc.) Harnableitung erfolgen.
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Zum Seitenanfang und Inhaltsverzeichnis
[vc_wp_search]
Literatur
