Antisynthetase-Syndrom
Artikel aktualisiert am 26. Oktober 2023
Das Antisynthetase-Syndrom (engl.:anti-synthetase syndrome, ASSD oder ASyS) wird als Subtyp der „idiopathischen entzündlichen Myopathie“, einer chronisch entzündlichen Muskelerkrankung, aufgefasst und ist mit einer interstitiellen Lungenerkrankung assoziiert. (1)Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653 (2)Clin Exp Rheumatol. 2022 Feb;40(2):309-319. doi: 10.55563/clinexprheumatol/8xj0b9. (3)Clin Exp Rheumatol. (2022) 40:309–19 (4)J Clin Med. 2019 Nov 18;8(11):2013. DOI: 10.3390/jcm8112013 Der Diagnose beruht auf der Trias:
- Myopathie (Muskelentzündung),
- Arthritis (Gelenkentzündung) und
- interstitielle Lungenerkrankung (ILD).
Zur Diagnosestellung gehört zudem
- der Nachweis von Antisynthetase-Antikörpern (Aminoacyl-tRNA-Synthetase-Antikörpern).
Behandlung und Prognose unterscheiden sich zwischen Antisynthetase-Syndrom und idiopathischer interstitieller Lungenerkrankung. Beide sind daher diagnostisch zu unterscheiden.
Inhaltsverzeichnis
Das Wichtigste verständlich
| Kurzgefasst |
| Das Das Antisynthetase-Syndrom ist ein Untertyp einer nicht infektiös bedingten Muskelentzündung (idiopathische entzündliche Myopathie) und mit einer ebenfalls nicht infektiös bedingten Lungenerkrankung assoziiert. Die Erkrankung betrifft verschiedene Organe und Strukturen des Körpers, vor allem Lungen, Gelenke und Muskeln.
Ursächlich ist ein abnorm reagierendes Immunsystem. Typisch ist der Beginn mit einer der 3 Hauptsymptome (Trias): Muskelentzündung (Myositis), Gelenkentzündung (Arthritis) und Lungenkrankheit mit Atemnot und Husten. Die Lungenkrankheit ist eine interstitielle Pneumonitis mit der Tendenz zur Entwicklung einer Lungenfibrose (diffuse Lungenvernarbung). Wenn bereits bei Vorliegen eines der Hauptsymptome Antisynthetase-Antikörper überprüft werden, kann in einem frühen Stadium bereits ein Antisynthetase-Syndrom wahrscheinlich gemacht und ihr Verlauf therapeutisch verlangsamt werden. Ohne frühzeitige Behandlung bezieht die Krankheit allmählich fortschreitend die anderen Symptome der Trias ein. Der Verlauf kann Schübe aufweisen und ist mit einer hohen Sterblichkeit (Mortalität) verbunden. Die Behandlung zielt auf das Immunsystem und beinhaltet meist Prednisolon und Azathioprin, bei unzureichendem Ansprechen auch Cyclophosphamid, Tacrolimus und Rituximab. |
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Entstehung, Untertypen
Die Ätiopathogenese ist nicht völlig geklärt. Das Zielantigen des Antisynthetase-Antikörpers, die Aminoacyl-tRNA-Synthetase, spielt bei der Übersetzung von mRNA in Protein eine Rolle. Ob sie eine Bedeutung für die Krankheitsentstehung hat, ist nicht bekannt.
Es lassen sich verschiedene Aminoacyl-tRNA-Synthetasen (ARS) differenzieren. Ihre Häufigkeit bei ASyS ist laut einer Publikation folgende: (5)J Clin Med. 2019 Nov 18;8(11):2013. DOI: 10.3390/jcm8112013 Anti-Jo1 (Myositis-spezifischer Antikörper, bei bis zu 88 % der ASyS-Patienten), Anti-PL7, Anti-PL12, Anti-OJ, Anti-EJ, Anti-KS, Anti -Zo und Anti-SC. In einer weiteren Untersuchung an 828 ASSD-Patienten hatten 593 Anti-Jo1-, 95 Anti-PL7-, 84 Anti-PL12-, 38 Anti-EJ- und 18 Anti-OJ-Antikörper. (6)J Clin Med. 2019 Nov 18;8(11):2013. doi: 10.3390/jcm8112013
Die Erkrankung beginnt meist mit nur einem der Symptome der o.g. Symptomtrias. Laut der AENEAS-Studie ist es häufig eine isolierte ILD (interstitielle Lungenkrankheit), eine Myopathie (Muskelerkrankung) oder eine Arthritis (Gelenkentzündung). (7)Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653
Bedeutung von Antikörper-Untertypen
Laut bisheriger Studien besteht kein wesentlicher Zusammenhang zwischen den klinischen Erscheinungsformen und verschiedenen Antikörperkonstellationen. Tendenzielle Zusammenhänge sind die folgenden: (8)Medicine (Baltimore). 2021 May 14;100(19):e25816. DOI: 10.1097/MD.0000000000025816
- Anti-Jo-1-, Anti-PL-7- und Anti-EJ-Antikörpern: mehr unspezifische interstitielle Pneumonie, mehr Myositis
- Anti-Jo-1: mehr Arthritis als bei Anti-PL-12- und Anti-EJ-Positivität
- Anti-PL-12: mehr organisierende Pneumonie und
- Anti-OJ-Antikörper: mehr gewöhnliche interstitielle Pneumonie; besonders schwere Muskelbeteiligung (9)JAMA Neurol. 2017 Aug 1;74(8):992-999. DOI: 1001/jamaneurol.2017.0934.
Eine Metaanalyse mit 3.487 Patienten zeigte eine etwas höhere Prävalenz einer ILD bei Nicht-Anti-Jo1- und einer Myositis bei Anti-Jo1-Patienten auf. (10)Autoimmun Rev. (2014) 13:883–91. 10.1016/j.autrev.2014.03.004
Anti-Jo1 ist der am häufigsten positive Antikörper. (11)Arch Rheumatol. 2022 Mar 3;37(3):424-434. DOI: 10.46497/ArchRheumatol.2022.9108. Anti-Jo1-positive Patienten zeigten in der AENEAS-Studie anfangs 21 % isolierte pulmonale Symptome; nach durchschnittlich 72 Monaten wurden bei 82 % der Anti-Jo1-positiven Patienten eine ILD (interstitielle Lungenkrankheit) festgestellt, von denen 20,8 % keine Symptome aufwiesen. (12)J Rheumatol. (2020) 47:415–23. 10.3899/jrheum.181141
Symptomatik
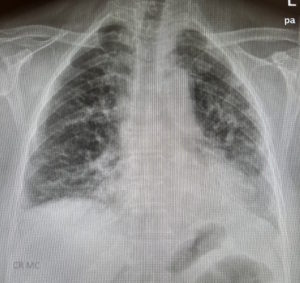
Die Symptomatik ist variabel und kann folgende Auswirkungen umfassen: (13)Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653
Lungenkrankheit: Eine interstitielle Lungenentzündung hat eine Prävalenz von 67 bis 100 %. Die häufigsten Symptome sind Husten und Dyspnoe. In einer Untersuchung hatten 42,2 % Pleuraergüsse. (14)Arthritis Rheumatol. (2018) 70:153–4
Myopathie: In 91% der Fälle wird eine Muskelschwäche mit unterschiedlicher Ausprägung beobachtet (15)Ann Rheum Dis. (2018) 77:30–9., die auch Schwierigkeiten beim Aufstehen oder Treppensteigen bewirken kann. Umgekehrt wurden bei 22 % der Patienten mit einer autoimmunen Myopathie Autoantikörper gegen Aminoacyl-tRNA-Synthetasen (ARSs) nachgewiesen. (16)Arthritis Res Ther. 2007;9(4):R78. DOI: 10.1186/ar2276 Anti-OJ-Antikörper waren in einer Untersuchung mit einer schweren Muskelstörung verbunden. (17)JAMA Neurol. 2017 Aug 1;74(8):992-999. DOI: 10.1001/jamaneurol.2017.0934 Es kann selten zu Muskelzellzerfall (Rhabdomyolyse) kommen, bei der besonders hohes Myoglobin und LDH im Blut nachweisbar sind und eine Nierenfunktionsstörung auftritt. (18)Rheumatol Int. 2018 Jun;38(6):1125-1130. DOI: 10.1007/s00296-018-4025-1
Arthritis: betroffen sind vor allem kleine Gelenke der Hände und Füße, unspezifisches Symptom in 18 bis 55 % der Fälle. Sie kann seronegative entzündliche, rheumatoide und CTD-assoziierter Arthritiden imitieren.
Raynaud-Phänomen: in 51% der Fälle im EuroMyositis-Register treten weiße Finger durch spastische Gefäßveränderungen an den Händen auf (siehe hier). Die Vaskulopathie kann auch zu schweren und anhaltenden Durchblutungsstörungen führen kann (s.u.).
Schwere digitale Ischämie: Solch eine Komplikation an den kleinen Blutgefäßen mit digitalen Ulzera kann in seltenen Fällen bei Patienten mit Antisynthetase-Antikörpern und mit dem Phänotyp einer systemischem Sklerose festgestellt werden. In diesen Fällen können systemischen Sklerose-spezifische Autoantikörper fehlen. (19)Case series and systematic literature review. J Scleroderma Relat Disord. 2022 Oct;7(3):204-216. … Continue reading Zugrunde liegt eine okklusive Vaskulopathie. (20)Eur J Rheumatol. 2017 Mar;4(1):63-65. DOI: 10.5152/eurjrheum.2017.16077
Differenzialdiagnosen
Patienten mit idiopathischer Lungenfibrose (IPF) unterscheiden sich von Patienten mit ASyS, da sie überwiegend Männer in höherem Alter betrifft. (21)Am J Respir Crit Care Med. (2018) 198:e44–68 Es gibt jedoch Überschneidungen von ASyS und IPF.
Die Muskelentzündung (Myositis) und die Arthritis im Rahmen eines ASSD haben jeweils eine Reihe von Differenzialdiagnosen, die geklärt werden müssen (s.u.). Bei Muskelsymptomen kommen verschiedene Formen aus der Gruppe der idiopathischen entzündlichen Myopathien (IIM) in Betracht. (22)Rheumatol Int. 2020 Feb;40(2):191-205. doi: 10.1007/s00296-019-04467-6
Diagnostik
Die Diagnostik umfasst hauptsächlich serologische Tests und bildgebende Verfahren. (23)Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653
Lungenkrankheit: Funktionsprüfung (Leistungsabnahme), Hochauflösende Computertomographie (HRCT): Nachweis einer unspezifischen interstitiellen Pneumonitis, (organisierende bzw. karnefizierende Pneumonitis, abakterielle toxisch bedingte Entzündung), bronchoalveoläre Lavage, ggf. Lungenbiopsie.
Laborwerte: Serologische Bestimmung von Antisynthetase-Antikörpern, ANA, Troponin T (cTnT), Laktatdehydrogenase (LDH) und Alanintransferase (ALT). Diese Werte können während einer Skelettmuskelentzündung erhöht sein.
82 % der ANA-negativen ASyS-Patienten hatten in einer Untersuchung eine positive zytoplasmatische Immunfluoreszenzfärbung, was auf das Vorhandensein von Antisynthetase-Antikörpern deutet. (24)J Rheumatol. 2017 Feb;44(2):223-229. DOI: 10.3899/jrheum.160618
Muskelschwäche: Quantifizierung über einen MMT8-Score durch manuelles Muskeltesten von acht Muskelgruppen; Elektromyographie. Eine Rhabdomyolyse (Muskelzerfall) lässt sich durch stark erhöhte Werte für Myoglobin und LDH im Serum nachweisen; sie sollten Anlass sein, die Nierenwerte zu bestimmen, da eine Crush-Niere durch verstopfte Nierenkörperchen auftreten kann.
Therapie
Die Behandlung von Patienten mit Anti-Synthetase-Syndrom beinhaltet häufig eine multimodale immunsuppressive Therapie. (25)Clin Pulm Med. 2016 Sep;23(5):218-226. DOI: 10.1097/CPM.0000000000000171
Lungenerkrankung: Die interstitielle Lungenerkrankung (ILD), spricht auf Kortikosteroide, Mycophenolat, Cyclophosphamid und Azathioprin an. Azathioprin kann die Kortikoiddosis reduzieren helfen. (26)Respir Med. 2013 Jun;107(6):890-6. DOI: 10.1016/j.rmed.2013.02.015 (27)Chest. 2019 Nov;156(5):896-906. DOI: 10.1016/j.chest.2019.05.023 In einem Fall hat eine zu Prednisolon zusätzliche Applikation von Tacrolimus eine entscheidende Verbesserung ergeben. (28)Respir Med Case Rep. 2022 Dec 15;41:101797. DOI: 10.1016/j.rmcr.2022.101797
In einem Fall einer lebensbedrohlichen interstitiellen Lungenkrankheit bei ASSD wurde Rituximab (RTX) eingesetzt und führte zu einer deutlichen Verbesserung. (29)Am J Ther. 2016 Mar-Apr;23(2):e639-45. DOI: 10.1097/MJT.0000000000000245 Eine Studie, bei der RTX verwendet wurde, wenn die Krankheit trotz Kortikosteroiden fortschritt oder wiederkam, zeigte in 79-88% eine Verbesserung der funktionellen Lungenparameter inkl. der Lungentotalkapazität. (30)J Rheumatol. 2018 Jun;45(6):841-850. DOI: 10.3899/jrheum.170541
Muskelerkrankung: Die Behandlung entzündlicher Myopathien basiert auf individuellen Erfahrungen und nicht auf Studien. (31)Lancet Neurol. 2018 Sep;17(9):816-828. doi: 10.1016/S1474-4422(18)30254-0
Im Fall einer schweren Myopathie mit Rhabdomyolyse ist eine systemische Behandlung mit Kortikosteroiden und Rituximab erfolgreich gewesen. (32)Rheumatol Int. 2018 Jun;38(6):1125-1130. DOI: 10.1007/s00296-018-4025-1
Verlauf und Prognose
Die Erkrankung neigt zu chronischem Verlauf mit allmählicher Verschlechterung und Schüben.
- Eine Langzeitstudie an 47 ASyS-Patienten mit Lungenbefunden zeigte, dass anfängliche nicht-fibrotische radiologische Veränderungen der Lungen bei 23,3 % verschwanden (n = 7), sich aber bei 6,7 % (n = 2) weiterentwickelten, bei 13,3 % (n = 4) bestehen blieben und bei 56,7 % (n = 17) fortschritten. Anfängliche fibrotische Muster im Röntgenbild blieben bei 82,4 % (n = 14) bestehen und schritten bei 17,6 % (n = 3) fort. (33)Eur Radiol. 2023 Feb 14. DOI: 10.1007/s00330-023-09439-w
- Eine retrospektive Studie an 62 Patienten mit interstitieller Lungenkrankheit im Rahmen eines ASyS besagt, dass Rituximab (+ Steroide) einen etwas besseren Langzeiterfolg nach 2 Jahren bewirkte als Cyclophosphamid (+Steroide). (34)J Rheumatol. 2020 Nov 1;47(11):1678-1686. doi: 10.3899/jrheum.190505
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Literatur
| ↑1 | Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653 |
|---|---|
| ↑2 | Clin Exp Rheumatol. 2022 Feb;40(2):309-319. doi: 10.55563/clinexprheumatol/8xj0b9. |
| ↑3 | Clin Exp Rheumatol. (2022) 40:309–19 |
| ↑4 | J Clin Med. 2019 Nov 18;8(11):2013. DOI: 10.3390/jcm8112013 |
| ↑5 | J Clin Med. 2019 Nov 18;8(11):2013. DOI: 10.3390/jcm8112013 |
| ↑6 | J Clin Med. 2019 Nov 18;8(11):2013. doi: 10.3390/jcm8112013 |
| ↑7 | Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653 |
| ↑8 | Medicine (Baltimore). 2021 May 14;100(19):e25816. DOI: 10.1097/MD.0000000000025816 |
| ↑9 | JAMA Neurol. 2017 Aug 1;74(8):992-999. DOI: 1001/jamaneurol.2017.0934 |
| ↑10 | Autoimmun Rev. (2014) 13:883–91. 10.1016/j.autrev.2014.03.004 |
| ↑11 | Arch Rheumatol. 2022 Mar 3;37(3):424-434. DOI: 10.46497/ArchRheumatol.2022.9108. |
| ↑12 | J Rheumatol. (2020) 47:415–23. 10.3899/jrheum.181141 |
| ↑13 | Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653 |
| ↑14 | Arthritis Rheumatol. (2018) 70:153–4 |
| ↑15 | Ann Rheum Dis. (2018) 77:30–9. |
| ↑16 | Arthritis Res Ther. 2007;9(4):R78. DOI: 10.1186/ar2276 |
| ↑17 | JAMA Neurol. 2017 Aug 1;74(8):992-999. DOI: 10.1001/jamaneurol.2017.0934 |
| ↑18 | Rheumatol Int. 2018 Jun;38(6):1125-1130. DOI: 10.1007/s00296-018-4025-1 |
| ↑19 | Case series and systematic literature review. J Scleroderma Relat Disord. 2022 Oct;7(3):204-216. doi: 10.1177/23971983221090857 |
| ↑20 | Eur J Rheumatol. 2017 Mar;4(1):63-65. DOI: 10.5152/eurjrheum.2017.16077 |
| ↑21 | Am J Respir Crit Care Med. (2018) 198:e44–68 |
| ↑22 | Rheumatol Int. 2020 Feb;40(2):191-205. doi: 10.1007/s00296-019-04467-6 |
| ↑23 | Front Med (Lausanne). 2022 Sep 14;9:959653. DOI: 10.3389/fmed.2022.959653 |
| ↑24 | J Rheumatol. 2017 Feb;44(2):223-229. DOI: 10.3899/jrheum.160618 |
| ↑25 | Clin Pulm Med. 2016 Sep;23(5):218-226. DOI: 10.1097/CPM.0000000000000171 |
| ↑26 | Respir Med. 2013 Jun;107(6):890-6. DOI: 10.1016/j.rmed.2013.02.015 |
| ↑27 | Chest. 2019 Nov;156(5):896-906. DOI: 10.1016/j.chest.2019.05.023 |
| ↑28 | Respir Med Case Rep. 2022 Dec 15;41:101797. DOI: 10.1016/j.rmcr.2022.101797 |
| ↑29 | Am J Ther. 2016 Mar-Apr;23(2):e639-45. DOI: 10.1097/MJT.0000000000000245 |
| ↑30 | J Rheumatol. 2018 Jun;45(6):841-850. DOI: 10.3899/jrheum.170541 |
| ↑31 | Lancet Neurol. 2018 Sep;17(9):816-828. doi: 10.1016/S1474-4422(18)30254-0 |
| ↑32 | Rheumatol Int. 2018 Jun;38(6):1125-1130. DOI: 10.1007/s00296-018-4025-1 |
| ↑33 | Eur Radiol. 2023 Feb 14. DOI: 10.1007/s00330-023-09439-w |
| ↑34 | J Rheumatol. 2020 Nov 1;47(11):1678-1686. doi: 10.3899/jrheum.190505 |
