Helicobacter-pylori-Gastritis
Artikel aktualisiert am 31. März 2024
Die Helicobacter-pylori-Gastritis, kurz Hp-Gastritis, ist eine chronische Magenschleimhautentzündung vom Typ B, die durch das Gram-negative und obligat pathogene Bakterium Helicobacter pylori (H.p.) ausgelöst und unterhalten wird. Eine Hp-Gastritis geht unbehandelt in eine chronisch-atrophische Verlaufsform über und gilt als Risikofaktor für Magenkrebs, ein Magenlymphom und wahrscheinlich auch für weitere Erkrankungen. Sie sollte daher erkannt und behandelt werden. (1)Mediators Inflamm. 2022 Mar 8;2022:2944156. DOI: 10.1155/2022/2944156.
Inhaltsverzeichnis
Das Wichtigste
| Kurzgefasst |
| Die Helicobacter-Gastritis (kurz Hp-Gastritis) ist eine in der Regel chronisch verlaufende Entzündung des Magens durch die Infektion mit dem Magenkeim Helicobacter pylori mit der Tendenz, im Laufe der Zeit zu einer Atrophie (Verdünnung, Verkümmerung) der Schleimhaut zu führen und das Magenkrebsrisiko zu erhöhen. Die Infektion erfolgt oral-oral oder fekal-oral meist bereits in der Kindheit.
Symptome: Das akute Stadium ist durch mehr oder weniger heftige Übelkeit und Brechreiz charakterisiert; es wird oft als „Magenverstimmung“ empfunden und später nicht mehr erinnert. Im chronischen Stadium können die Symptome völlig verschwinden, oder es können unspezifische Oberbauchbeschwerden (Dyspepsie) entstehen. Komplikationen: Zu den schwerwiegendsten Folgen und Komplikationen gehören das Magen- und Zwölffingerdarmgeschwür und der Magenkrebs. Assoziationen: Es besteht eine Assoziation einer Helicobacter-Infektion mit der Arteriosklerose, dem Glaukom, der Migräne und der Präeklampsie. Sie sollten sie bei der Diagnostik mit berücksichtigt werden – bzw. umgekehrt: wenn sie vorliegen, sollte nach einer Helicobacter-Infektion gesucht werden. 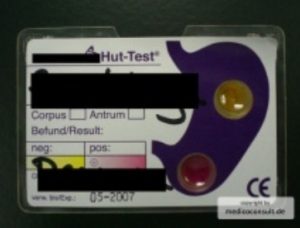 Diagnostik: Die Erkennung sowohl einer Gastritis als auch einer Helicobacter-Infektion der Magenschleimhaut erfolgt zuverlässig durch die Histologie. Sie wird durch eine Magenspiegelung gewonnen. Die Besiedlung der Magenschleimhaut mit Helicobacter-Keimen kann durch eine chemische Reaktion in einem Schnelltest noch während einer Magenspiegelung entdeckt werden. Therapie: Die Behandlung stützt sich auf eine Kombination von Antibiotika und Säureblocker (Hemmer der Magensäureproduktion). Wegen der möglichen Entwicklung von Resistenzen der Keime gegen verschiedene Antibiotika, sind ausgeklügelte Therapie-Regime erforderlich (siehe hier). Prognose: Die chronische Verlaufsform einer Hp-Gastritis führt zu einer Schleimhautatrophie (Abnahme von Drüsen, Vermehrung von Fasern, Epithelmetaplasie: chronisch atrophische Gastritis) und beinhaltet ein erhöhtes Risiko eines Magentumors (Magenkrebs, Magenlymphom). In Ostasien ist das Risiko von Magenkrebs ausgeprägter als in westlichen Ländern. Die Reinfektionsrate nach Eradikation (Auslöschung) der Magenkeime ist gering. → Zum Magenkeim Helicobacter siehe hier. |
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Entstehung
Die Infektion der Magenschleimhaut mit Helicobacter pylori erfolgt über eine orale Aufnahme (oral-oral, fekal-oral).
Helicobacter pylori (H.p.) bildet Urease in großen Mengen, deren Bedeutung noch nicht völlig geklärt ist. Das enzymatisch entstehende Ammonium dient möglicherweise über eine lokale pH-Anhebung durch Säureneutralisation zur besseren Kolonisierung der Magenschleimhaut. Andererseits benötigt das Bakterium offenbar einen sauren Magen-pH. (2)Infect Immun 1995; 63: 1669-1673
Nach Infektion mit Helicobacter pylori entsteht initial eine akute Gastritis mit Vermehrung der Säurebildung (bis zu einem Nüchtern-pH von 7,0). Histologisch findet sich eine neutrophile Gastritis mit Helicobacter-Nachweis in der Schleimhaut, wobei das Bakterium spezifisch im Bereich des Magenepithels (nicht im Bereich intestinaler Metaplasien) gefunden wird (Gewebstropismus). Helicobacter wird auch in gastralen Heterotopien im Bulbus duodeni gefunden.
Die Lipopolysaccharide von Helicobacter pylori ähneln denen der Lewis-Blutgruppen-Oberflächenantigene der gastralen Mukosazellen, so dass auch die Entstehung einer Immuntoleranz vermutet wird. (3)Glycobiology. 2009 May;19(5):453-61 Sie fördert wahrscheinlich nach initialer Infektion eine Persistenz des Keims auf und in der Mukosa des Magens. (4)Curr Opin Gastroenterol. 2006 Jan;22(1):3-7
Auf eine Infektion erfolgt eine adaptive Th1-Antwort des Immunsystems. Sie reicht jedoch nicht aus, um den Keim zu beseitigen. Vermutlich lässt sich die unzureichende adaptive Immunantwort des Körpers durch bakterieller Faktoren erklären, die zu einer schlechten Aktivierung von Toll-like-Rezeptoren und einer Induktion regulatorischer T-Zell-Antworten führt. (5)Helicobacter. 2008 Oct;13 Suppl 1:18-22. DOI: 10.1111/j.1523-5378.2008.00636.x.
Bei Chronifizierung der Hp-Gastritis nehmen lymphozytäre Infiltrationen zu; es entsteht allmählich eine Schleimhautatrophie mit Abnhame der Drüsen und einer Vermehrung von Bindegewebsfasern; und es nimmt – möglicherweise als Folge der daraus folgenden Abnahme der Säurebildung (Hypochlorhydrie) – die Helicobacter-Besiedlung ab. (6)Gastroenterology 1996; 110: 926-938 Antikörper gegen Helicobacter pylori können offenbar mit Schleimhautantigenen kreuzreagieren, so dass auch autoimmunologische Mechanismen diskutiert werden. (7)Gastroenterology 1991; 101: 437-445 In jedem Fall wird das Immunsystem des Körpers durch die Keime in seiner Reaktivität verändert. (8)Best Pract Res Clin Gastroenterol. 2007;21(2):237-59. doi: 10.1016/j.bpg.2007.01.001.
Die Kolonisation bzw. Infektion der Magenschleimhaut mit Helicobacter bedeutet ein erhöhtes Risiko für peptische Geschwüre sowie für Adenokarzinome des Antrums oder Korpus (9)NEJM 1991; 325: 1127-1131 (10)Lancet 1993; 341: 1359-1362 oder eines Magenlymphoms (MALT-Lymphom, B-Zell-Lymphom der Magenwand). Es gibt diverse Stämme mit unterschiedlicher Pathogenität. Die Stämme cagA+, vac s1, iceA1 sind offenbar in dieser Beziehung besonders pathogen. Das Magenkarzinomrisiko (Cardiakarzinome ausgeschlossen) ist bei Hp-Befall bis zu 150-fach höher als bei nichtinfizierten Personen. Das auf dem Boden einer Hp-Gastritis erhöhte Risiko für ein Magenkarzinom (ausgenommen ist das Cardiakarzinom) ist pathogenetisch nicht vollständig verstanden. Das Risiko bleibt offenbar auch nach Eradikation von H.p. noch erhöht. (11)Adv Med Sci. 2007;52:55-60
Symptomatik und Verlauf
Akute Phase: Nach Erstinfektion bzw. Inokulation des Magens mit Helicobacter pylori entwickelt sich eine akute Gastritis mit meist milden bis mäßigen, manchmal auch heftigen und krampfartigen epigastrischen Schmerzen, sowie Übelkeit und (seltener) Erbrechen. Gelegentlich verläuft eine Erstinfektion unbemerkt.
In ca. 80% wird die Infektion chronisch. Die meisten Menschen mit einer chronischen Infektion bleiben asymptomatisch. Einige entwickeln eine funktionelle Dyspepsie, d. h. unbestimmte Magenbeschwerden.
Chronsiche Phase: Bei jahrelangem Verlauf kann es zu Symptomen durch Folgen der sich entwickelnden chronisch-atrophischen Gastritis kommen. Die Schleimhautatrophie betrifft hauptsächlich den Corpus des Magens (i. G. zur Typ-A-Gastritis, bei der sie den Fundus des Magens betrifft). Sie ist mit einem erhöhten Krebsrisiko verbunden. (12)J Environ Pathol Toxicol Oncol. 2018;37(3):241-259. DOI: … Continue reading Anhaltende Inappetenz, Völlegefühl und Übelkeit können durch eine chronische aktive Gastritis, aber auch durch ein Magenkarzinom bedingt sein.
Solche Symptome sind daher durch eine Magenspiegelung (Gastroskopie) abzuklären, vor allem wenn sich eine Gewichtsabnahme hinzugesellt. Es gilt einen Tumor (MALT-Lymphom, Magenkarzinom, neuroendokrine Tumore) auszuschließen oder rechtzeitig zu erkennen. Tumore dieser Art sind mit einer chronisch-atrophischen Gastritis als Folge einer Hp-Infektion assoziiert. (13)PLoS Pathog. 2017 Nov 2;13(11):e1006653. DOI: 10.1371/journal.ppat.1006653.
Histologie
Epithelschädigung und entzündliche Infiltrate in der Lamina propria mit polymorphkernigen Granulozyten, Eosinophilen und Lymphozyten (dem Mukosa-assoziierten lymphatischen Gewebe (MALT) zugehörig, oft lymphoide Follikel in der Histologie). Im Laufe der Jahre entwickelt sich eine atrophische Gastritis (jährlicher Prävalenzanstieg um ca 1-3%), und es lassen sich zunehmend intestinale Metaplasien nachweisen. Beide Veränderungen erhöhen das Risiko der Entwicklung eines Magenkarzinoms.
Diagnostik
Die Diagnostik einer Helicobacter-Gastritis stützt sich auf den direkten Nachweis des Bakteriums oder seiner Bestandteile oder Stoffwechselprodukte. Der Nachweis von Antikörpern im Wirt gegen Helicobacter ist nicht beweisend; Antikörper können längere Zeit nach Eradikation weiterhin nachweisbar bleiben.
- Histologischer Nachweis (PE bei Endoskopie): er gilt heute als Goldstandard für den Nachweis einer Helicobacter-Besiedlung der Magenschleimhaut. Die HE-Färbung ist geeignet zur Beurteilung des Gewebes und eines starken Helicobacter pylori-Befalls, die Silber-Färbung nicht zur Gewebsbeurteilung sondern nur des Helicobacter-pylori-Befalls (sensitiv), die Genta-Färbung lässt beides gut erkennen.
- Urease-Nachweis in einer Gewebeprobe (PE bei Endoskopie): dieser Schnelltest beruht auf einem Farbumschlag z. B. eines Agargelplättchens durch die Urease-Aktivität der Gewebsprobe. Antibiotika oder Protonenpumpenblocker (PPI) können zu falsch negativen Ergebnissen führen. Sensitivität und Spezifität > 90%. Dieser Test ist am günstigsten, wenn eine Gewebeprobe nicht histologisch untersucht werden muss.
- Harnstoff-Atemtest: markierter Harnstoff (13C oder 14C) wird bei Helicobacter pylori-Befall im Magen zersetzt; das entstehende markierte CO2 wird in der Atemluft gemessen (Massenspektrometrie bzw. Szintillationszähler nötig). Sehr aussagekräftige, nicht invasive Methode, aber wenig sensitiv bei geringem Befall. Sie eignet sich zur Therapiekontrolle.
- H. pylori-Stuhl Antigen-Test: scheint in seiner Empfindlichkeit und Aussage dem Harnstoff-Atemtest äquivalent zu sein; Sensitivität und Spezifität liegen bei 90%. Er weist eine aktive Infektion nach.
- PCR auf H.p.-DNA: dieser Nachweis ist zu 98% spezifisch. Er weist eine aktive Infektion nach.
- Helicobacter-Kultur: Sie ist spezifisch, aber aufwändig. In der Regel ist sie wegen der hohen Aussagekraft der Histologie und des Urease-Schnelltests nicht erforderlich und daher nicht gerechtfertigt. Sie wird meist nur zur Resistenztestung bei fehlgeschlagener Eradikation und weiterbestehender Symptomatik und nachweisbarer aktiver Gastritis durchgeführt.
Bei unklaren Oberbauchbeschwerden ist oft eine Gastroskopie indiziert. Bei der Gelegenheit sollte eine Biopsie aus Antrum und Corpus entnommen und histologisch aufgearbeitet und am besten parallel auch per Urease-Schnelltest untersucht werden. Dabei wird sich ein möglicher Befall mit Helicobacter pylori zeigen. Eine Endoskopie bei asymptomatischen Personen alleine zum Zweck eines Helicobacter pylori-Nachweises gilt als nicht indiziert.
Umgebungsuntersuchungen
Es sollte bei der Diagnostik berücksichtigt werden, dass eine Helicobacter-Infektion nicht nur mit einer Gastritis und dem Magenkrebs, sondern auch mit der Arteriosklerose (14)He C. J Atheroscler Thromb. 2014 Oct 24., einem Glaukom (15)Glob J Health Sci. 2014 Sep 18;6(7 Spec No):38263, der Migräne (16)World J Gastroenterol. 2014 Oct 28;20(40):14965-72 und der Präeklampsie (17)Front Immunol. 2014 Oct 9;5:484 assoziiert ist.
Unter diesem Gesichtspunkt sollte bei positivem Helicobacter-Nachweis auch nach solchen Krankheiten gefahndet werden, und umgekehrt sollten solche Krankheiten nach einem Helicobacterbefall suchen lassen. Bei positivem Ergebnis wäre eine Eradikation anzuraten!
Therapie
Die Behandlung der Helicobacter-Infektion der Magenschleimhaut wird heute großzügiger als früher gestellt. Ziel ist es, eine Eradikation zu erreichen, um Komplikationen und Folgen zu vermeiden und Symptome zu lindern. Um das Magenkrebs-Risiko zu senken, sollte die Behandlung frühzeitig einsetzen, um der Entwicklung einer Magenschleimhautatrophie und von intestinalen Metaplasien rechtzeitig vorzubeugen.
Es gibt absolute und relative Indikationen für eine Eradikations-Therapie. Zu den absoluten Indikationen zählen die frische Hp-Gastritis und das MALT-Lymphom.
Die Behandlung beinhaltet einen Protonenpumpenhemmer (PPI) und eine Kombination von 2 oder 3 Antibiotika, wobei Amoxicillin, Chinolone, Metronidazol, Makrolide und Rifampicin gängig sind. Gegen Clarithomycin und Metronidazol entsteht eine zunehmende Resistenz. Entsprechend gibt es eine Reihe von Kombinationen, die als Erstlinien- oder Zweitlinientherapie und als Reservetherapie vorgeschlagen werden. Dazu siehe hier.
Es ist unsicher und umstritten, ob sich eine ausgeprägte chronische Schleimhautatrophie nach Eradikation wieder bessern kann. (18)Postgrad Med. 2022 Apr 13:1-6. DOI: 10.1080/00325481.2022.2063604
Erneute Infektion nach erfolgreicher Eradikation
Nach einer Helicobacter-Eradikation liegt die Reinfektionsrate statistisch bei etwa 1 % pro Jahr.
Prognose
Ein Helicobacter-Befall der Magenschleimhaut bedeutet ein erhöhtes Risiko für
- ein Magenulkus,
- ein Magenkarzinom und
- ein Magenlymphom.
Wegen der Epithelmetaplasien in einer chronisch-atrophischen Gastritis, die als Praekanzerose wirkt, sollte eine qualitativ hochwertige endoskopische Kontrolle alle 3 Jahre erfolgen. (19)Postgrad Med. 2022 Apr 13:1-6. DOI: 10.1080/00325481.2022.2063604
Risiko Magenkarzinom
Eine chronische Helicobacter-Infektion ist die häufigste Ursache für Magenkrebs. (20)Nat Rev Cancer. 2010 Jun;10(6):403-14. doi: 10.1038/nrc2857. In Japan ist die schwere Helicobacter-assoziierte Gastropathie mit einem Risiko von etwa 3 % mit der Entwicklung eines Magenkarzinoms verbunden; Patienten mit Magenulcera bei Helicobacter-Infektion haben ein höheres Risiko, solche mit Duodenalulzera ein deutlich niedrigeres. (21)NEJM 2001; 345: 784-789 Der bakterielle Virulenzfaktor, der zu dem hohen Krebsrisiko führt, ist als CagA (Cytotoxin-assoziiertes Gen A) identifiziert worden. (22)Sci Rep. 2019 Jan 10;9(1):38. doi: 10.1038/s41598-018-37095-4. In westlichen Ländern ist das Magenkrebsrisiko wegen Überwiegen anderer Helicobacterstämme (siehe hier) geringer.
Eine erfolgreiche Helicobacter-Eradikation senkt (laut einer japanischen Arbeit) das Risiko für Magenkrebs über einen Zeitraum von mindestens 10 Jahren. (23)J Gastroenterol. 2015 Jun;50(6):638-44. DOI: 10.1007/s00535-014-1004-5. Inzwischen gilt eine Eradikation als eine Prävention. Die Mortalität sank einer Untersuchung zufolge innerhalb von 2 Jahren um 39 %. (24)Gut. 2020 Dec;69(12):2113-2121. DOI: 10.1136/gutjnl-2020-320839
Risiko Refluxkrankheit
Da eine Helicobacter-pylori-Infektion zu einer chronischen Gastritis mit reduzierter Säureproduktion führt, wurde vermutet, dass eine Eradikation zu einer erneut höheren Magensäureproduktion und damit zu vermehrten Refluxbeschwerden führt. Dies ist jedoch offenbar nicht der Fall, so dass auch Refluxpatienten mit gleichzeitig vorliegender Helicobacter-Gastritis ohne erhöhtes Risiko einer Verschlechterung eradiziert werden können. (25)Gastroenterology 2001; 121: 1120-1126
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Patienteninfos
→ Zum Seitenanfang und Inhaltsverzeichnis
Literatur
| ↑1 | Mediators Inflamm. 2022 Mar 8;2022:2944156. DOI: 10.1155/2022/2944156. |
|---|---|
| ↑2 | Infect Immun 1995; 63: 1669-1673 |
| ↑3 | Glycobiology. 2009 May;19(5):453-61 |
| ↑4 | Curr Opin Gastroenterol. 2006 Jan;22(1):3-7 |
| ↑5 | Helicobacter. 2008 Oct;13 Suppl 1:18-22. DOI: 10.1111/j.1523-5378.2008.00636.x. |
| ↑6 | Gastroenterology 1996; 110: 926-938 |
| ↑7 | Gastroenterology 1991; 101: 437-445 |
| ↑8 | Best Pract Res Clin Gastroenterol. 2007;21(2):237-59. doi: 10.1016/j.bpg.2007.01.001. |
| ↑9 | NEJM 1991; 325: 1127-1131 |
| ↑10 | Lancet 1993; 341: 1359-1362 |
| ↑11 | Adv Med Sci. 2007;52:55-60 |
| ↑12 | J Environ Pathol Toxicol Oncol. 2018;37(3):241-259. DOI: 10.1615/JEnvironPatholToxicolOncol.2018026839. |
| ↑13 | PLoS Pathog. 2017 Nov 2;13(11):e1006653. DOI: 10.1371/journal.ppat.1006653. |
| ↑14 | He C. J Atheroscler Thromb. 2014 Oct 24. |
| ↑15 | Glob J Health Sci. 2014 Sep 18;6(7 Spec No):38263 |
| ↑16 | World J Gastroenterol. 2014 Oct 28;20(40):14965-72 |
| ↑17 | Front Immunol. 2014 Oct 9;5:484 |
| ↑18 | Postgrad Med. 2022 Apr 13:1-6. DOI: 10.1080/00325481.2022.2063604 |
| ↑19 | Postgrad Med. 2022 Apr 13:1-6. DOI: 10.1080/00325481.2022.2063604 |
| ↑20 | Nat Rev Cancer. 2010 Jun;10(6):403-14. doi: 10.1038/nrc2857. |
| ↑21 | NEJM 2001; 345: 784-789 |
| ↑22 | Sci Rep. 2019 Jan 10;9(1):38. doi: 10.1038/s41598-018-37095-4. |
| ↑23 | J Gastroenterol. 2015 Jun;50(6):638-44. DOI: 10.1007/s00535-014-1004-5. |
| ↑24 | Gut. 2020 Dec;69(12):2113-2121. DOI: 10.1136/gutjnl-2020-320839 |
| ↑25 | Gastroenterology 2001; 121: 1120-1126 |
