Autoimmungastritis (Typ-A-Gastritis)
Artikel aktualisiert am 19. Dezember 2023
Die Autoimmungastritis ist eine durch Selbstangriff des Immunsystems auf die Magenschleimhaut zustande kommende chronische Magenschleimhautentzündung (chronische Gastritis). Sie wird als Typ-A-Gastritis klassifiziert.
→ Der Magen
→ Funktion der Magenschleimhaut
Inhaltsverzeichnis
Entstehung
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Ursache der Autoimmungastritis sind Autoantikörper. Die Bildung von Autoantikörpern beruht generell auf einer Fehlregulation des Immunsystems (siehe hier). Im Fall der Typ-A-Gastritis lassen sich Anti-Parietalzell-Antikörper nachweisen, also Antikörper gegen die Zellen, welche am Mageneingang die für die Verdauung nötige Salzsäure bilden. Sie sind gegen die Protonenpumpe der Parietalzellen (eine H+/K+-ATPase) gerichtet. (1)Nat. Rev. Dis. Primers. 2020;6:56. doi: 10.1038/s41572-020-0187-8 Folgen sind
- eine immunologisch ausgelöste Entzündung des Magenfundus (oberer Schleimhautbezirk im Magen, in dem sich diese Zellen befinden, siehe hier).
- ein Säuremangel (Hypo-/Achlorhydrie): er führt zu einem reaktiven Anstieg des Gastrinspiegels. In der Folge erhöht sich das Risiko für neuroendokrine Tumore. Der Säuremangel bewirkt im Magen eine mangelhafte Aktivierung des Eiweiß-verdauenden Pepsins, was zu Verdauungsstöungen führen kann.
- ein Mangel an „Intrinic Faktor“: Durch den Angriff auf die Parietalzellen kommt es auch zu einem Mangel an „Intrinsic Faktor“ (Castle-Faktor), einem Hilfsmolekül, das dem Magensaft beigemischt wird, um die Resorption von Vitamin B12 im unteren Dünndarm zu ermöglichen. Fehlt der Faktor, so kommt es im Laufe der Zeit zu einem Vitamin-B12-Mangel, der eine Blutarmut, die perniziöse Anämie, und neuropsychiatrische Symptome (funikuläre Myelose) zur Folge hat.
Bei einer chronischen Autoimmungastritis (CAG) verändert sich die Histologie der Magenschleimhaut kontinuierlich. Es entwickelt sich eine Atrophie mit dem erhöhten Risiko für einen Übergang in eine Metaplasie, Dysplasie und schließlich ein Neoplasma (tumorartige Neubildung). Das Risiko eines neuroendokrinen Tumors im Magen (z. B. über eine reaktive G-Zell-Hyperplasie im Antrum: Risiko Gastrinom) und eines Adenokarzinoms in Fundus/Cardia ist erhöht. (2)Digestion. 2022;103(1):45-53. doi: 10.1159/000519337 (3)ACG Case Rep J. 2021 Aug 24;8(8):e00649. doi: 10.14309/crj.0000000000000649
Als Autoimmunkrankheit tritt die Typ-A-Gastritis gehäuft mit anderen Austoimmunkrankheiten auf, so mit autoimmunen Schilddrüsenerkrankungen, einschließlich der Basedow-Hyperthyreose und der Hashimoto-Thyreoiditis (4)J Endocrinol Invest. 2016 Jul;39(7):779-84 und dem Diabetes mellitus Typ 1.
Mangelerscheinungen
Die autoimmune Fundusgastritis ist mit einem Mangel an Vitamin B12 und einer daraus resultierenden perniziösen Anämie verbunden. Es werden weitere Mangelerscheinungen beobachtet: ein Eisenmangel, der ebenfalls eine Anämie verursacht, weitere Vitamine und Mikronährstoffe, wie Vitamin C, Vitamin D, Folsäure und Calcium. Sie können jeweils zu dem Symptomenkomplex der Typ-A-Gastritis beitragen. (5)World J Gastroenterol. 2017 Jan 28;23(4):563-572. DOI: 10.3748/wjg.v23.i4.563 Der Eisenmangel kann zu einer mikrozytären Anämie führen, die der makrozytären Anämie durch den B12-Mangel vorausgehen kann. (6)Acta Biomed. 2018 Dec 17;89(8-S):88-92. DOI: 10.23750/abm.v89i8-S.7921
→ Vitamin-B12-Mangel
→ Eisenmangel
Symptome, Beschwerden, Komplikationen
Anämiesymptome (Perniziöse Anämie): Zu ihnen gehören Konzentrationsstörungen und Leistungsabnahme (siehe hier).
Hunter’sche Glossitis: Typisch für eine perniziöse Anämie ist eine mit ihr häufig assoziierte hochrote und geschwollene Zunge, die Hunter’sche Glossitis. Sie kann brennende Beschwerden hervorrufen.
Dyspepsie als Folge der mangelhafte Pepsinwirkung und ggf. auch wegen einer bakteriellen Besiedlung des Magens: Die Autoimmungastritis verläuft über viele Jahre symptomlos oder mit nur geringen unspezifischen abdominellen Beschwerden (Dyspepsie); sie wird daher meist erst spät entdeckt.
Neurologische und psychiatrische Symptome: Es können sich neurologische und psychiatrische Erkrankungen manifestieren. Zu ihnen gehören eine periphere Polyneuropathie mit Taubheitsgefühlen oder Kribbeln (in 25 % der Fälle), eine Neuropathie des Sehnerven oder Hörnerven, eine Neigung zur Depression oder kognitive Probleme. (7)Diagnostics (Basel). 2021 Nov 15;11(11):2113. DOI: 10.3390/diagnostics11112113 (8)Acta Biomed. 2018;89:88–92
Thromboseneigung: Die Autoimmungastritis ist häufig mit einem Anstieg des Homocysteinspiegels im Blut assoziiert, der wiederum (über eine Schädigung der Endothelzellen der Blutgefäße) zu einer erhöhten Thromboseneigung führt. Mit ihm ist auch ein erhöhtes kardiovaskuläres Risiko verbunden. (9)Acta Biomed. 2018;89:88–92
Diagnostik
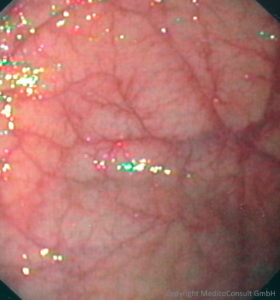
Auf die Spur einer Typ-A-Gastritis gerät man
- zufällig, wenn im Rahmen einer aus anderen Gründen durchgeführten Gastroskopie eine Gewebeprobe aus dem Fundus entnommen wird,
- bei der Suche nach der Ursache einer hyperchromen makrozytären Anämie.
Der Nachweis von Antikörpern gegen Parietalzellen (Antiparietalzellantikörper) und gegen den Intrinsic-Faktor (Anti-Intrinsicfaktor-Antikörper, seltener positiv) ergibt die Diagnose einer Perniziösen Anämie. (10)Aliment. Pharmacol. Ther. 2019;50:167–175. doi: 10.1111/apt.15317
Der Nachweis einer atrophen Fundusgastritis in einer Gewebeprobe (Biopsie), die während einer Magenspiegelung (Gastroskopie) entnommen wird, sichert zusammen mit dem Nachweis der Autoantikörper, die Diagnose einer Typ-A-Gastritis.
Diagnostik von assoziierten Krankheiten
Mit der Typ-A-Gastritis geht ein erhöhtes Risiko für Magenkrebs und neuroendokrine Tumore einher. Die Diagnostik schließt die Suche nach ihnen und deren Verlaufsüberwachung ein.
Zu den häufiger assoziierten Krankheiten gehören der Typ-1-Diabetes, eine Autoimmunthyreoiditis, eine Vitiligo, aber auch viele andere Autoimmunkrankheiten, wie die PBC, die PSC, die AIH, oder die Myasthenie (siehe hier). (11)Diagnostics (Basel). 2021 Nov 15;11(11):2113. DOI: 10.3390/diagnostics11112113 Insbesondere autoimmune Schilddrüsenkrankheiten (Morbus Morbus Basedow, Hashimoto-Thyreoiditis) werden in die Diagnostik einbezogen. (12)Gastroenterology. 2021 Oct;161(4):1325-1332.e7. doi: 10.1053/j.gastro.2021.06.078
Zur Diagnostik gehört ebenso eine Statusaufnahme bezüglich einer Hypovitaminose und des Calciumstoffwechsels inkl. des Knochenstatus sowie die Bestimmung der Homocysteinkonzentration im Blut (s. o.).
Da eine Assoziation zu einer perniziösen Anämie und zu neurologischen Störungen mit Nervendegeneration (funikuläre Myelose) besteht, sind diese Folgen in die Diagnostik ebenfalls einzubeziehen.
Wegen der Assoziation zu anderen Autoimmunkrankheiten werden Autoantikörper,
Therapie und Prognose
Die Autoimmungastritis führt zu einer chronischen Schleimhautatrophie, die therapeutisch nicht aufgehalten werden kann.
Wegen der erhöhten Gefährdung bezüglich Magenkrebs sollte in regelmäßige Abständen (bei fortgeschrittener Schleimhautatrophie z. B. jährlich) eine Magenspiegelung erfolgen. Das optimale Überwachungsintervall für Personen mit Autoimmungastritis wird von der Amerikanischen Gastroenterologischen Assoziation (AGA) als ungeklärt bezeichnet. Es sollte in gemeinsamer Entscheidungsfindung mit dem Patienten individuell festgelegt werden. (13)Gastroenterology. 2021 Oct;161(4):1325-1332.e7. doi: 10.1053/j.gastro.2021.06.078
→ Mehr zur Autoimmungastritis siehe hier.
Verweise
Literatur
| ↑1 | Nat. Rev. Dis. Primers. 2020;6:56. doi: 10.1038/s41572-020-0187-8 |
|---|---|
| ↑2 | Digestion. 2022;103(1):45-53. doi: 10.1159/000519337 |
| ↑3 | ACG Case Rep J. 2021 Aug 24;8(8):e00649. doi: 10.14309/crj.0000000000000649 |
| ↑4 | J Endocrinol Invest. 2016 Jul;39(7):779-84 |
| ↑5 | World J Gastroenterol. 2017 Jan 28;23(4):563-572. DOI: 10.3748/wjg.v23.i4.563 |
| ↑6 | Acta Biomed. 2018 Dec 17;89(8-S):88-92. DOI: 10.23750/abm.v89i8-S.7921 |
| ↑7 | Diagnostics (Basel). 2021 Nov 15;11(11):2113. DOI: 10.3390/diagnostics11112113 |
| ↑8 | Acta Biomed. 2018;89:88–92 |
| ↑9 | Acta Biomed. 2018;89:88–92 |
| ↑10 | Aliment. Pharmacol. Ther. 2019;50:167–175. doi: 10.1111/apt.15317 |
| ↑11 | Diagnostics (Basel). 2021 Nov 15;11(11):2113. DOI: 10.3390/diagnostics11112113 |
| ↑12 | Gastroenterology. 2021 Oct;161(4):1325-1332.e7. doi: 10.1053/j.gastro.2021.06.078 |
| ↑13 | Gastroenterology. 2021 Oct;161(4):1325-1332.e7. doi: 10.1053/j.gastro.2021.06.078 |
