Gastrointestinale Stromatumore
Artikel aktualisiert am 14. März 2023
Gastrointestinale Stromatumore (GIST) sind sehr selten und kommen eher bei älteren Menschen vor. Unter der nicht epithelialen (mesenchymalen) Tumore des Magendarmtrakts sind sie die häufigsten. Kleine Tumore unter 2 cm Durchmesser haben eine gute Prognose. Eine Operation ist in frühen Stadien meist kurativ. Für nicht operable Tumore stehen Medikamente zur Verfügung, die zu einer deutlichen Verbesserung der Prognose führen. (1)Clin Cancer Res. 2021 Dec 1;27(23):6333-6342. doi: 10.1158/1078-0432.CCR-21-1864
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Inhaltsverzeichnis
Das Wichtigste
| Kurzgefasst |
| Gastrointestinale Stromatumore sind seltene Tumore, die endoskopisch meist unter der Schleimhaut des Magens oder anderer Bereiche des Magendarmtrakts als rundliche, gut verschiebliche derbe Vorwölbungen erkennbar sind.
Am häufigsten treten sie bei älteren Menschen im achten Lebensjahrzehnt auf. Ihre Lokalisation ist meist im Magen, aber auch im Dünndarm, Omentum, Mesenterium und Rektosigmoid. Je größer die Tumore sind, desto größer ist die Wahrscheinlichkeit einer Bösartigkeit (Malignität) und von Tochtergeschwülsten (Metastasen), z. B. in Leber und Lungen. Für die Diagnose ist eine Gewebeprobe und ihre Untersuchung unter dem Mikroskop (Histologie) entscheidend. Kleine Tumore können endoskopisch (im Rahmen einer Spiegelung) entfernt werden, große operativ. Wenn der Tumor nicht operabel ist, oder wenn er bei der Operation nach Größe und histologisch als mittel oder hoch maligne eingestuft wird, dann besteht ein hohes Risiko von Metastasen. Metastasen können auch noch nach einer als heilend eingeschätzten („kurativen“) Operation auftreten. In inoperablen oder nicht nicht heilend operierten Fällen vermögen Medikamente, wie Imatinib, die Prognose deutlich zu verbessern. Die therapeutischen Optionen werden in Zukunft durch MikroRNA wohl wesentlich erweitert! |
Definition
1983 wurde der Begriff „Gastrointestinaler Stromatumor“ für mesenchymale (nicht epitheliale) Tumore des GI-Trakts eingeführt. Anfangs zählte man wegen der Ähnlichkeit der spindelförmigen Zellen zu glatten Muskelzellen vor allem myogenen Ursprungs (Leiomyome, Leiomyosarkome) hinzu und auch Schwannome. (2)World J Gastrointest Oncol. 2013 Jun 15;5(6):102-12 Von echten Leiomyomen und Schwannomen lassen sich GIST durch positives CD34 differenzieren. (3)Am J Surg Pathol. 1995 Feb; 19(2):207-16 Heute werden GIST charakterisiert durch eine CD117-Expression auf der Zelloberfläche. (4)Mod Pathol. 1998 Aug;11(8):728-34 Zur histologischen Diagnose siehe hier.
Epidemiologie
Die Inzidenz der gastrointestinalen Stromatumore (GIST) ist gering. Es treten etwa 6 – 15% neue Fälle pro 1 Million pro Jahr auf, davon sind 54% Männer und 46% Frauen. Die Prävalenz in der Bevölkerung liegt bei 129 pro 1 Million. (5)Am J Gastroenterol. 2005 Jan; 100(1):162-8 (6)Cancer. 2005 Feb 15;103(4):821-9 Die Erkrankung beginnt meist in einem Alter von über 40 Jahren; das mittlere Alter liegt bei 65 Jahren. (7)J Gastrointest Oncol. 2012 Sep; 3(3):189-208 Etwa jeder vierte (27 %) Patient hat bei Erstdiagnose einen kleinen GIST unter 2 cm Durchmesser, von denen 79 % zufällig gefunden wurden. (8)Eur J Surg Oncol. 2017 Jul;43(7):1344-1349. DOI: 10.1016/j.ejso.2017.01.240
Entstehung
Gastrointestinale Stromatumore (GIST) entwickeln sich wahrscheinlich aus Cajal-Zellen. (9)J Clin Onkol 2004; 22: 3813-3825 Cajal-Zellen gelten als spezialisierte glatte Muskelzellen, die im Darmkanal eine Schrittmacherfunktion für die Peristaltik ausüben. (10)Annu Rev Physiol. 2006; 68():307-43 Sie finden sich in der glatten Muskulatur des Darms und im Auerbach-Plexus. Die Tumor-entscheidende Mutation betrifft ein Gen, welches für die KIT-Rezeptor-Tyrosinkinase kodiert, in über 80%. (11)Science. 1998 Jan 23; 279(5350):577-80
Charakteristisch für einen gastrointestinalen Stromatumor ist die Expression von CD117 auf der Zelloberfläche (Typ-III-Rezeptor-Thyrosinkinase, in ca. 95% positiv, codiert auf Chromosom 4, c-KIT-Gen). CD117 kann diagnostisch genutzt werden. Mutationen dieses Gens bewirken, dass die Thyrosinkinase auch unabhängig vom Liganden des Rezeptors (natürlicherweise der Stammzellfaktor SCF) ständig aktiviert ist. Dadurch reagieren die Zellen mit unkontrolliertem Wachstum und sind gleichzeitig geschützt vor Apoptose. Die Daueraktivierung der Thyrosinkinase scheint wichtig für die Prognose der Gastrointestinalen Stromatumore zu sein. Dies ist die Grundlage dafür, dass eine Behandlung mit Tyrosinkinasehemmern einen therapeutischen Effekt haben (siehe unten).
Klinik
Die Symptomatik richtet sich nach Größe und Lokalisation. Kleine Tumore werden durch Zufall entdeckt und sind meist symptomlos. Große Tumore können durch Schmerzen oder eine akute gastrointestinale Blutung mit Bluterbrechen auffallen. Metastasen treten vor allem in der Leber und im Peritoneum auf. Symptome wie Übelkeit und Abgeschlagenheit sowie eine gastrointestinale Blutung sind meist schon Zeichen eines fortgeschrittenen Tumors.
Lokalisation
GIST sind meist im Magen (60-70%) oder Duodenum (30-40%) lokalisiert, seltener im Ösophagus (5%) und übrigen Darmtrakt (5-10%). Die GIST entstehen immer in der Muskelschicht des betreffenden Darmabschnitts. Wenn ein gastrointestinaler Stromatumor metastasiert, finden sich meist gleich Fernmetastasen in Leber und Lungen, kaum dagegen Metastasen in regionalen Lymphknoten.
Entartungsrisiko
Die Unterscheidung von benignen und malignen gastrointestinalen Stromatumoren ist schwierig. Metastasen zeigen Malignität an. Ansonsten sind die Tumorgröße und die Mitoserate die verlässlichsten Kriterien. (12)Cancer. 2005 Feb 15;103(4):821-9 (13)Eur J Surg Oncol. 2017 Jul;43(7):1344-1349. DOI: 10.1016/j.ejso.2017.01.240
Das Entartungsrisiko ist
- sehr gering bei Größe < 2 cm
- gering bei Größe 2-5 cm
- mittel bis hoch bei Größe >5 cm (assoziiert ist eine Erhöhung der Mitosezahl im Blickfeld)
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Diagnostik

Der Verdacht auf einen GIST kommt meist erst auf, wenn klinische Symptome auftreten und aus solch einem Grund eine Gastroskopie (Magenspiegelung) durchgeführt wird. Es sind unter der Schleimhaut (submukös) gelegene glatte rundliche Erhabenheiten, die eine weitere Diagnostik veranlassen. Bildgebende Verfahren führen meist zu einer engeren Eingrenzung der Diagnosen. Die Endosonographie spielt dabei eine besondere Rolle, da sie sehr hoch auflöst und gleichzeitig über die heute meist simultan durchgeführte Duplexuntersuchung Aufschluss über die Blutversorgung gestattet.
Wenn Unsicherheiten bestehen oder eine besondere therapeutische Konsequenz zu ziehen ist, erfolgt die weitere Abklärung durch die Histologie, wobei die neuen immunhistochemischen Marker (CD117 und GOG-1, s. u.) besonders hilfreich sind. Die für die Histologie erforderliche Biopsie gelingt gelegentlich endoskopisch durch eine Knopflochbiopsie, allerdings kann auch eine Operation indiziert sein.
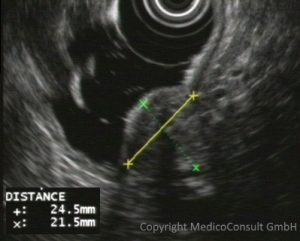
Da kaum regionäre Lymphknotenmetastasen, sondern häufig gleich Fernmetastasen entstehen, müssen besonders Leber und Lungen untersucht werden, z.B. durch eine Kontastmittel-Sonographie, MRT, CT oder/und PET.
Histologie, Immunhistologie
Die Histologie der gastrointestinalen mesenchymalen Tumore ist ohne Marker schwierig zu interpretieren. Marker mit hoher Sensitivität und Spezifität sind CD117 und DOG-1.
CD117: Diagnostisch entscheidend ist der immunhistochemische Nachweis von CD117. Ein Tumor wird als Gastrointestinaler Stromatumor diagnostiziert, wenn er im Bereich des Darmkanals liegt, spindelzellig oder epitheloidzellig (wie ein GIST) ist und immunhistochemisch eindeutig positiv für CD117 reagiert. In einer Zusammenstellung von 288 als GIST diagnostizierten Fällen fanden sich nach diesen Kriterien 28% GIST, 34% Leiomyome, 13% Leiomyoblastome, 18% Leiomyosarkome, und 7% andere mesenchymale Tumore wie Schwannome oder Neurofibrome. (14)Cancer. 2005 Feb 15;103(4):821-9
DOG-1: Ein weiterer GIST-Marker ist DOG-1, der dem Kaliumtransporter ANO1 entspricht. Er hat eine höherer Sensitivität und Spezifität als CD117. Die Kombination beider Marker wird als beste Möglichkeit betrachtet, die Sicherheit der Diagnose eines GIST zu erhöhen. (15)Scand J Gastroenterol. 2013 Sep;48(9):1055-65
Bedeutung der PET für die GIST-Diagnostik
Kontrollen auf Tumorrezidive und weitere Metastasen durch Bildgebung inklusive Positronenemissionstomographie (PET). Die PET eignet sich nicht nur zur Lokalisationsdiagnostik (Metastasensuche) sondern auch zur Aktivitätseinschätzung und zur Feststellung des Ansprechens der Therapie, da die Glukoseaufnahme sensitiver reagiert als die Größe des Tumors. In sehr seltenen Fällen kann offenbar ein Schwannom, das meist benigne verläuft und als Differenzialdiagnose eines GIST in Betracht kommt, ebenfalls 18F-FDG aufnehmen und zu einer Fehldiagnose führen. (16)J Nucl Med. 2015 Jan-Apr;18(1):74-6
Therapie
Früher hatte man nur die chirurgische Resektion als entscheidende Therapie zur Verfügung. Heute haben Thyrosinkinasehemmer wie Imatinib zu einer wesentlichen Verbesserung der Prognose beigetragen. Neue Entwicklungen betreffen Inhibitoren von Hsp90, einem „Heat shock protein“, die einen günstigen Effekt auf den Verlauf ausüben sollen.
- Chirurgische Resektion. Im Magen bei kleinen Tumoren ggf. nur Magenwandresektion, je nach Größe auch Teilresektion oder Gastrektomie. Im Dünndarm Segmentresektion mit Sicherheitsabstand und Lymphadenektomie segmentärer und vergrößerter Lymphknoten. Es setzt sich zunehmend die Meinung durch, dass auch kleine GIST chirurgisch entfernt werden sollten. Es wird immer eine Vollwandresektion angestrebt, da der Tumor aus der Mucularis entsteht. Wenn bei größeren Tumoren eine R0-Resektion fraglich ist, wird eine neoadjuvante Therapie mit Imatinib empfohlen. (17)Arch Surg 2001; 136: 383-389 (18)Der Chirurg 2008; 79:644-649 (19)Der Chirurg 2008; 79:630-637
- Therapie mit dem Tyrosinkinase-Inhibitor (TKI) Imatinib bei Rezidiven und Metastasierung. (20)N Engl J Med 2001; 344: 1052-1056 (21)Lancet 2001; 358:1421-1423 (22)N Engl J Med 2002; 347: 472-480 Patienten mit einer c-kit-Mutation in Exon 11 (etwa 70% der Patienten) sprachen in etwa 70% an. Inzwischen wird Imatinib auch Erstlinientherapie bei fortgeschrittenem GIST empfohlen; es hat in bisherigen Studien die Überlebenszeit erheblich verlängert. (23)Br J Cancer. 2007 Jun 4;96(11):1656-8 (24)World J Gastrointest Oncol. 2013 Jun 15;5(6):102-12 Die 9-Jahres-Überlebensrate liegt zwischen 35 und 49%. In den Studien wurde bestätigt, dass KIT-Exon-11-Mutationen besser ansprechen als Patienten mit Wildtyp, KIT-Exon-9-Mutationen oder anderen Mutationen. (25)J Clin Oncol. 2010 Mar 1;28(7):1247-53 Imatinib wird als neoadjuvante Therapie zum „downstagen“ (Erniedrigung des Tumorstadiums) vor einer Operation empfohlen, um die Heilungschance zu erhöhen. (26)Indian J Med Paediatr Oncol. 2014 Oct;35(4):244-8
→ Siehe auch unter Imatinib und Tyrosinkinasehemmer. - Sunitinib ist eine Alternative bei Imatinib-Resistenz; Genanalyse des Tumors ist sinnvoll, denn c-kit-Mutationen in Exon 9 sprechen besser, in Exon 11 schlechter an. (27)Curr Opin Oncol. 2007 Jul;19(4):353-8
Das therapeutische Vorgehen bei GIST folgt dem Schema: (28)Indian J Med Paediatr Oncol. 2014 Oct;35(4):244-8
- Operative Therapie aussichtsreich? Wenn ja, dann neoadjuvante Chemotherapie mit Imatinib und adjuvante Therapie nach der Operation.
- In progredienten und nicht operablen Fällen Chemotherapie mit Imatinib, gefolgt von Sunitinib, gefolgt von bester palliativ unterstützender Pflege („best supportive care“).
Zu den weiteren medikamentösen Optionen der zweiten und dritten Linie gehört neben Sunitinib auch Regorafenib. Beide haben jedoch relativ niedrige Ansprechraten und begrenzten klinischen Nutzen.
Ripretinib und Avapritinib sind neuere Optionen für die Behandlung eines GIST mit PDGFRA-Exon-18-Mutation: (29)J Hematol Oncol. 2021 Jan 5;14(1):2. DOI: 10.1186/s13045-020-01026-6
Ripretinib ist ein TKI, das viele der häufigsten Mutanten, die für ein primäres oder sekundäres Therapieversagen von Imatinib verantwortlich sind, hemmt. Die Nebenwirkungen entsprechen im Wesentlichen denen der anderen TKI-Medikamente. Die häufigsten Nebenwirkungen sind laut Studien Anstiege der Lipase, Bluthochdruck, Müdigkeit und Hypophosphatämie. Ripretinib wurde zur Behandlung von fortgeschrittenem GIST bei Erwachsenen zugelassen, die bereits drei oder mehr TKI erhalten haben. (30)Lancet Oncol. 2020 Jul;21(7):923-934. DOI: 10.1016/S1470-2045(20)30168-6. (31)Therap Adv Gastroenterol. 2021 Apr 15;14:17562848211008177. doi: 10.1177/17562848211008177 (32)Drugs. 2022 Oct;82(15):1541-1548. DOI: 10.1007/s40265-022-01794-0
Bedeutung einer genetischen Analyse für die GIST-Therapie
Mutationen in Exon 11 sind bei weitem am empfindlichsten bezüglich der Wirkung von Imatinib (siehe hier). Mutation in Exon 9 bedeutet erhöhte Empfindlichkeit auf Sunitinib (s.u.). Nur etwa 5% der GIST sind KIT-negativ.
Bedeutung von MikroRNA für die Therapie
MikroRNA spielen bei der Tumorentstehung und seiner Invasivität eine bedeutende Rolle. Die MikroRNA miR-34a and miR-335 werden als Kandidaten betrachtet, mit denen man die Profilaration von gastrointestinalen Stromatumoren supprimieren kann. Sie hemmen die Migration und Invasion von GIST-Zellen und regulieren in vitro eine Reihe von in die Tumorprogredienz involvierten Genen herunter. (33)PLoS One. 2015 Jul 27;10(7):e0133754. doi: 10.1371/journal.pone.0133754
Therapieerfolg und Prognose
Das Risiko einer Malignität hängt mit Größe, Mitosezahl und histologischem Typ des Tumors zusammen. Wird ein Tumor reseziert, so besteht eine Wahrscheinlichkeit von 50%, dass er in der Folge rezidiviert. Die Rezidive treten dann meist in Leber und Lungen auf.
Prognostisch günstig sind
- ein nur kleiner Tumor,
- ein spindelzelliger Typ und
- wenige Mitosen im histologischen Schnitt.
Eine Mitosezahl von 5 und mehr pro Gesichtsfeld in der hohen Auflösung spricht für eine schlechte Prognose. (34)Wien Med Wochenschr. 2013 Mar; 163(5-6):137-52
Eine adjuvante Therapie mit Imatinib verbessert die Prognose bei operablen Tumoren (s. o.). Eine länger dauernde Behandlung führt zu besseren Langzeitergebnissen als kurzdauernde Behandlungen. Eine Therapie von 36 Monaten nach einer Operation verbesserte das Überleben nach 3 Jahren gegenüber einer von 12 Monaten von 82% auf 92%. (35)JAMA. 2012 Mar 28; 307(12):1265-72
Neue Entwicklung: Hsp90-Inhibitoren
In GIST und anderen Tumozelltypen ist Heatshockprotein 90 (Hsp90) hochreguliert. (Heatshockproteine sind Zellproteine, welche Klient-Proteine vor Abbau schützen.) Hemmstoffe von Hsp90 führen in vitro zum Absterben von GIST-Zelllinien, auch von solchen, die resistent gegen Imatinib sind. (36)Cancer Res. 2006 Sep 15; 66(18):9153-61 Einer der entwickelten Hemmstoffe ist Ganetespib (STA-9090). Es besteht die Aussicht auf Zulassung als Antikrebsmittel. (37)Onco Targets Ther. 2015 Jul 24;8:1849-58 Inzwischen wurde eine Wirksamkeit gegen eine Reihe von Tumoren nachgewiesen, bei denen es zum Wachstumsstillstand führt. Die Wirkung beruht auf einer Anregung einer Apoptose. In klinischen Phase-II-Studien wird es als Erstlinientherapie für metastasierenden Brustkrebs getestet. (38)Int J Mol Sci. 2023 Mar 6;24(5):5014. DOI: 10.3390/ijms24055014 (39) Clin Cancer Res. 2013;19(21):6020–6029
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Autor: Prof. Dr. Hans-Peter Buscher (s. Impressum)
Literatur
| ↑1 | Clin Cancer Res. 2021 Dec 1;27(23):6333-6342. doi: 10.1158/1078-0432.CCR-21-1864 |
|---|---|
| ↑2 | World J Gastrointest Oncol. 2013 Jun 15;5(6):102-12 |
| ↑3 | Am J Surg Pathol. 1995 Feb; 19(2):207-16 |
| ↑4 | Mod Pathol. 1998 Aug;11(8):728-34 |
| ↑5 | Am J Gastroenterol. 2005 Jan; 100(1):162-8 |
| ↑6 | Cancer. 2005 Feb 15;103(4):821-9 |
| ↑7 | J Gastrointest Oncol. 2012 Sep; 3(3):189-208 |
| ↑8 | Eur J Surg Oncol. 2017 Jul;43(7):1344-1349. DOI: 10.1016/j.ejso.2017.01.240 |
| ↑9 | J Clin Onkol 2004; 22: 3813-3825 |
| ↑10 | Annu Rev Physiol. 2006; 68():307-43 |
| ↑11 | Science. 1998 Jan 23; 279(5350):577-80 |
| ↑12 | Cancer. 2005 Feb 15;103(4):821-9 |
| ↑13 | Eur J Surg Oncol. 2017 Jul;43(7):1344-1349. DOI: 10.1016/j.ejso.2017.01.240 |
| ↑14 | Cancer. 2005 Feb 15;103(4):821-9 |
| ↑15 | Scand J Gastroenterol. 2013 Sep;48(9):1055-65 |
| ↑16 | J Nucl Med. 2015 Jan-Apr;18(1):74-6 |
| ↑17 | Arch Surg 2001; 136: 383-389 |
| ↑18 | Der Chirurg 2008; 79:644-649 |
| ↑19 | Der Chirurg 2008; 79:630-637 |
| ↑20 | N Engl J Med 2001; 344: 1052-1056 |
| ↑21 | Lancet 2001; 358:1421-1423 |
| ↑22 | N Engl J Med 2002; 347: 472-480 |
| ↑23 | Br J Cancer. 2007 Jun 4;96(11):1656-8 |
| ↑24 | World J Gastrointest Oncol. 2013 Jun 15;5(6):102-12 |
| ↑25 | J Clin Oncol. 2010 Mar 1;28(7):1247-53 |
| ↑26 | Indian J Med Paediatr Oncol. 2014 Oct;35(4):244-8 |
| ↑27 | Curr Opin Oncol. 2007 Jul;19(4):353-8 |
| ↑28 | Indian J Med Paediatr Oncol. 2014 Oct;35(4):244-8 |
| ↑29 | J Hematol Oncol. 2021 Jan 5;14(1):2. DOI: 10.1186/s13045-020-01026-6 |
| ↑30 | Lancet Oncol. 2020 Jul;21(7):923-934. DOI: 10.1016/S1470-2045(20)30168-6. |
| ↑31 | Therap Adv Gastroenterol. 2021 Apr 15;14:17562848211008177. doi: 10.1177/17562848211008177 |
| ↑32 | Drugs. 2022 Oct;82(15):1541-1548. DOI: 10.1007/s40265-022-01794-0 |
| ↑33 | PLoS One. 2015 Jul 27;10(7):e0133754. doi: 10.1371/journal.pone.0133754 |
| ↑34 | Wien Med Wochenschr. 2013 Mar; 163(5-6):137-52 |
| ↑35 | JAMA. 2012 Mar 28; 307(12):1265-72 |
| ↑36 | Cancer Res. 2006 Sep 15; 66(18):9153-61 |
| ↑37 | Onco Targets Ther. 2015 Jul 24;8:1849-58 |
| ↑38 | Int J Mol Sci. 2023 Mar 6;24(5):5014. DOI: 10.3390/ijms24055014 |
| ↑39 | Clin Cancer Res. 2013;19(21):6020–6029 |
