Das Wichtigste verständlich
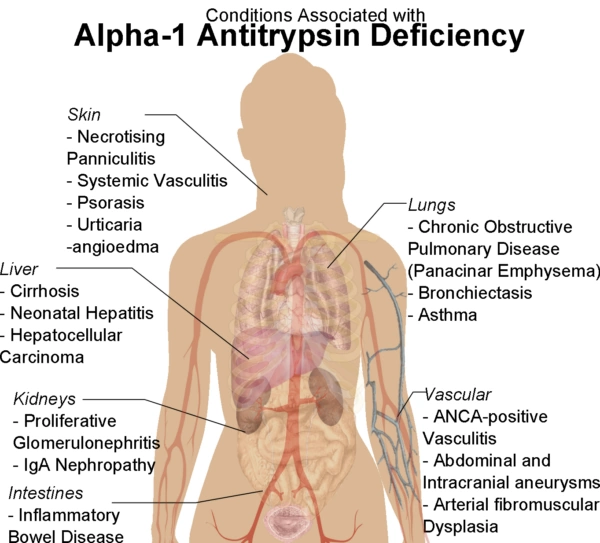
| Der Alpha1-Antitrypsinmangel ist eine seltene angeborene Stoffwechselstörung der Leber, die zu einer Leberzirrhose führen und eine ausgeprägte Lungenüberblähung (Lungenemphysem) bewirken kann. Sie wird trotz sicherer Diagnosemöglichkeiten wahrscheinlich nur in jedem 10. Fall erkannt. Die Krankheit verläuft langsam und wird oft erst spät diagnostiziert oder sogar übersehen. Ihre Häufigkeit wird auf etwa 1 auf 2000-3500 Neugeborene geschätzt. Betroffen sind in Deutschland schätzungsweise 8 – 16000 Menschen. Ursache Das AAT-Protein (Wildtyp: M-Typ) ist zum Z-Typ mutiert. Zwei Z-Allele ergeben eine homozygote Genetik. Auswirkungen, Symptome Viele homozygote ZZ-Träger bleiben symptomarm und undiagnostiziert. Einige erleiden frühzeitig eine Erkrankung der Lungen und / oder der Leber. Lungen: Die Stoffwechselstörung verursacht eine verminderte Sekretion von Schleim und einen unzureichendem Schutz der Lungenbläschen (Alveolen). Mit der Zeit kommt es zu einer Zerstörung der Lungenstruktur mit Entwicklung eines schon im Kindesalter entstehenden Emphysems und zu entzündlichen Aussackungen der Atemwege (Bronchiektasen). Leber: Die Leber kann mit einem Gallestau (Cholestase) reagieren; eine verlängerte Neugeborenengelbsucht kann ein erstes Zeichen der Krankheit sein. Später kann sich eine Narbenleber (Leberzirrhose) ausbilden. Diagnostik Klinische Hinweise können sein: ein verlängerter Neugeborenenikterus (Gelbsucht), ein früh sich entwickelndes Lungenemphysem und Bronchiektasen in jungen Jahren. Ein Fehlen der Alpha-1-Zacke in der Elektrophorese macht die Krankheit sehr wahrscheinlich. Oft wird eine AATD durch aufmerksame Beurteilung eine Serum-Elektrophorese, die aus anderen Gründen indiziert wurde, zufällig entdeckt. Eine genetische Analyse (AAT protein phenotype) bestätigt die Diagnose und ergibt den Typ (homozygot: PiZZ). Behandlung Die Behandlung hat erhebliche Fortschritte gemacht. Mit humanem Anti-1-Antitrypsin wird ein weitgehend normales Leben ermöglicht. Eine Gentherapie sowie eine Behandlung über Transplantation leberspezifischer pluripotenter Stammzellen ist in Entwicklung. Im Endstadium einer AATD-bedingten Lungen- oder Leberkrankheit kommt eine entsprechende Organtransplantation in Frage. Eine Lebertransplantation führt zur Heilung mit ausgezeichnetem Langzeitüberleben. |
Ursache und Entwicklung
Der Alpha1-Antitrypsinmangel (AAT-Mangel, AATD: AAT deficiency) ist eine erbliche Krankheit, die bei Neugeborenen zu einer schweren Leberkrankheit (verlängerte Neugeborenengelbsucht) und später zu einem frühzeitigen und ausgeprägten Lungenemphysem (Überblähung) führt.
Alpha-1-Antitrypsin (AAT) ist ein ist ein akute-Phase-Protein und wird zu 90% in der Leber gebildet und ins Blut abgegeben. Es gehört zur Superfamilie der Serpine (Serinprotease-Inhibitoren) und hemmt neutrophile Serinproteasen, wie Elastase, Proteinase 3 und Cathepsin G, und Nicht-Serinproteasen, wie Caspasen und Metalloproteasen. Es beeinflusst die Bildung von Zytokinen und übt eine immunmodulatorische und breite entzündungshemmende Wirkung aus. Menschliches AAT schützt Hirnzellen (durch Beeinflussung von Zytokinen) vor Schädigung durch Sauerstoff- und Glukosemangel. 1
Eine der wichtigsten Aufgaben des AAT besteht darin, bei einer akuten Infektion die Entwicklung einer chronischen Entzündung und Organschädigung zu verhindern. In der akuten Phase der Entzündung wird daher AAT vermehrt gebildet (siehe unter Akute-Phase-Proteine). Ein Mangel führt zu einer erhöhten Entzündungsneigung, die sich besonders an den Lungen und der Leber manifestiert. 2 3
Beim Alpha-1-Antitrypsinmangel handelt es sich ursächlich um eine Mutation des SERPINA1-Gens auf Chromosom 14 (a1AT-Gen, SERPINA1-Gen). 4 Eine einzelne Aminosäuremutation (Lys342Glu) führt zur Bildung des Z-AAT-Proteins, das fehlerhaft gefaltet ist und sich intra- und extrazellulär verkettet (polymerisiert). Die Fehlfaltung bewirkt, dass sich große Proteinpolymere in den Hepatozyten ansammeln, wodurch eine chronische Leberkrankheit befördert wird. Ganz entsprechend können sich bei Kindern ein Gallestau (Cholestase) mit Gelbsucht und bei Erwachsenen eine Leberzirrhose und die Neigung zu einem hepatozellulären Karzinom (Leberkrebs) entwickeln. 5
Mutationen: Inzwischen sind über 100 Mutationen bekannt. Allele, die bei Leberbeteiligung gefunden werden: Z, S, Mi, duarte, M malton. Am häufigsten liegt die ZZ-Mutation vor.
- Eine homozygote Ausprägung (PiZZ = Proteaseinhibitor, ZZ Phänotyp) führt zu einer Erkrankung.
- Eine heterozygote Ausprägung (PiMZ) bedeutet, dass die betreffende Person ohne Symptome, aber Überträger der Erkrankung ist (normaler Phänotyp = PiMM).
Die Ausprägung ist sehr variabel, was auf einen Einfluss von Umweltfaktoren schließen lässt 6.
In der Leber kommt es zur Bildung großer Mengen an mutiertem Z-Protein, das wegen atypischer Faltung nicht normal sezerniert wird und keine Antitrypsin-Wirkung mehr erzielt. Seine Ansammlung lässt sich histochemisch nachweisen und ist für die Störung der Leberfunktion mit Cholestase bei Säuglingen und Kleinkindern verantwortlich. Die unzureichende Sekretion führt zu einem Enzymmangel im Blut, was sich besonders in der Lunge auswirkt. Die Leberzellen (Hepatozyten), die am meisten mit dem pathologischen Z-Polymer überladen sind, unterliegen einem programmierten Zelltod (Apoptose) und bedingen eine Aktivierung der „stellate cells“ (Ito-Zellen), die Kollagenfasern produzieren und eine allmähliche Vernarbung (Leberfibrose, Leberzirrhose) in Gang setzen. 4 Der Prozess kann beim ZZ-Typ in seltenen Fällen bereits in frühem Kindesalter einsetzen („neonatal hepatitis syndrome”). 7
In der Lunge kommt es durch den AAT-Mangel zu einer Zerstörung der Lungenalveolen und der frühzeitigen Bildung eines Emphysems. Zustande kommt dies durch eine verminderten Hemmung der Elastase von neutrophilen Granulozyten, was zu einem vermehrten Abbau von elastischem Gewebe in den Lungen (Abbau von Elastin) führt. 8
Klinik
Bei Neugeborenen ist der Alpha-1-Antitrypsinmangel die häufigste Ursache einer neonatalen Lebererkrankung (Hepatopathie) mit erhöhten Leberwerten und Cholestase, die in einigen Fällen zu einer konsekutiven Fibrose und Leberzirrhose führen kann. Etwa 1/4 der homozygoten PiZ-Träger (PiZZ) entwickeln eine Leberzirrhose. In diesen Fällen besteht auch ein erhöhtes Leberkrebs-Risiko. Die Leberwerte können sich jedoch auch wieder bessern.
Bei Kindern kann ein AAT-Mangel sehr unterschiedlich verlaufen. Ein Lungenemphysem im Kindes- oder Jugendlichenalter kann zur Diagnose leiten. Eine durch ihn bedingte Lebererkrankung kann nur vorübergehend auftreten und nur eine verlängerte Neugeborenen-Gelbsucht hervorrufen, er kann aber auch zu einer chronischen Krankheit der Leber mit Fibrose und Zirrhose fortschreiten, die eine Lebertransplantation schon im Kindesalter erforderlich machen kann. 9
Bei Erwachsenen dominiert in etwa 3/4 der Fälle eine Lungenerkrankung mit einem früh, meist im 3.-5. Lebensjahrzehnt auftretenden Lungenemphysem mit chronischem Husten und Bronchiektasen. Auch bei heterozygoten PI MZ Genotyp-Trägern besteht ein deutlich erhöhtes Risiko für eine Lungenerkrankung. 10 8
Diagnostik
Hinweise auf einen AAT-Mangel können sein:
- eine verlängerte Neugeborenengelbsucht und
- eine Neigung zu Atemwegserkrankungen, insbesondere zu Bronchitiden mit Schleimretention, häufigem Husten sowie frühzeitigem Emphysem bei Kindern und Jugendlichen. 10
Die Prognose ist vom frühzeitigen Verdacht auf das Vorliegen der Erkrankung und der daraufhin frühzeitigen Diagnostik abhängig. Als Goldstandard gilt die genetische Analyse. Voraussetzung ist die Erkennung der klinischen und laborchemischen Hinweise (s.u.). 7
Labor
Elektrophorese: Die normalerweise gut erkennbare Alpha-1-Zacke in der Elektrophorese fehlt oder ist sehr niedrig.
Genetische Analyse
Die Bestimmung des Genotyps (z- und s-Mutation im AAT-Gen) sichert die Diagnose. Als Indikation für die Untersuchung gilt
- eine erniedrigte Alpha-1-Zacke in der Elektrophorese,
- eine positive Familienanamnese,
- eine chronische Bronchitis im Kindesalter,
- eine ungeklärte Erhöhung der Leberwerte schon bei Säuglingen und Kleinkindern,
- ein prolongierter neonataler Ikterus.
Histologie
Histologisch findet man PAS-positive Einschlüsse in periportalen Hepatozyten, die resistent gegen die Verdauung durch Diastase sind.
Leber- und Lungenbeteiligung
Eine Leberschädigung durch einen AAT-Mangel ist häufig und sollte frühzeitig diagnostiziert werden: Leberwerte, Sonographie der Leber, Messung der Lebersteifigkeit (Fibroscan, MR-Elastographie).
Eine Lungenbeteiligung wird durch folgende technischen Untersuchungen objektiviert: Lungenfunktionsmessung, Lungendensitometrie, Diffusionskapazität von Kohlenmonoxid ()DLCO), Nachweis von Bronchiektasen und einer COPD-Symptomatik. 11
Gelegentlich besteht nur eine Lungensymptomatik, die auf eine COPD (chronisch obstruktive Lungenkrankheit) bzw. auf Bronchiektasen schließen lassen (chronischer Husten, mukopurolentes Sputum, wiederkehrende Infektionen). Manche dieser Manifestationen sind auf einen AAT-Mangel zurückzuführen, so dass bei der Primärdiagnostik immer auch auf einen AAT-Mangel hin untersucht werden sollte. Dies gilt auch für eine unerklärte Leberzirrhose.
Therapie
Eine intravenöse Applikation von gentechnisch hergestelltem humanen Alpha-1-Antitrypsin (Prolastin ®) zur Behandlung und Vorbeugung der Lungenerkrankung (einmal wöchentliche Infusion) hat eine entscheidende Verbesserung der Prognose ergeben. Eine Zusammenstellung der Erfahrungen über 25 Jahre zeigt den günstigen Effekt einer deutlichen Verzögerung bezüglich des Fortschreitens einer schweren Lungenkrankheit. 12 13 Eine große Studie (RAPID/RAPID Extension program) zeigt, dass die Infusionstherapie den Krankheitsverlauf positiv beeinflusst und die Progredienz verlangsamt 14 15.
Bei fortgeschrittener Lungenkrankheit kann eine Lungentransplantation, bei fortgeschrittener Leberzirrhose eine Lebertransplantation in Frage kommen. Eine Lebertransplantation bedeuet Heilung, da in der transplantierten gesunden Leber normales Alpha-1-Antitrypsin (M-Typ) gebildet wird. Die 5-Jahres-Überlebensrate nach LTX beträgt etwa 90%. 16
Lungen- und Lebertransplantation
Die Lungenkrankheit ist die häufigste Folge einer AATD (Alpha-1-AntiTrypsin Disease); die zweithäufigste ist eine Leberzirrhose. Bei ihr ist das Risiko von Leberkrebs (hepatozelluläres Karzinom) erhöht. In ihren Endstadien ist eine Organtransplantation (der Lungen / der Leber) eine Therapieoption.
Patienten mit einer ein- bzw. doppelseitige Lungentransplantation wegen AATD haben eine kürzere komplikationsfreie Zeit nach der Transplantation als lungentransplantierte COPD-Patienten, aber ein besseres Langzeitüberleben. 17 Eine alleinige Lungentransplantation hat jedoch den Nachteil, dass das Emphysem wiederkehren kann. 18
Die Transplantation einer gesunden Leber führt dagegen zu einer genetischen Heilung, denn die transplantierte Leber produziert normal funktionierendes AAT. Eine kombinierte Lungen-Leber-Transplantation ist möglich; aber bei AATD-Patienten existiert bisher wenig Erfahrung. 19 Patienten mit einer Lebertransplantation bei AATD wegen einer Leberzirrhose im Endstadium haben eine sehr gute Prognose. Die Überlebensrate nach 1 Jahr lag in einer Zusammenstellung bei 97,8%, nach 5 Jahren bei 95,5% und nach 20 Jahren bei 98,1%. 20
Perspektiven
Eine Gentherapie ist möglicherweise ein therapeutischer Weg der Heilung. 21 Das Prinzip besteht darin, das nicht mutierte AAT-Gen über ein Virus in die Leberzellen zu schleusen. In Studien wird nach intramuskulärer Injektion eines viralen Vektors (rAAV1-AAT: recombinant adeno-associated virus (rAAV) mit Erbinformation für AAT) ein Anstieg der AAT auf 3% des Zielwerts gefunden. 22 Dies ist damit zwar noch deutlich zu gering, aber begründet therapeutische Hoffnungen. 23 Im Gegensatz zur Gentherapie bei Hämophilie stellt die ausreichende Bereitstellung von funktionsfähigem Enzym zur Vorbeugung der Lungen- und Leberkrankheit eine der größten Herausforderungen. Daher werden verschiedene Virus-Vektoren untersucht und die CRISPR/Cas9-Technik verwendet, um die genetische Information möglichst effektiv wirksam werden lassen können. 24
Eine Transplantation leberspezifischer pluripotenter Stammzellen ist ein Ansatz, der im Tierversuch auf eine therapeutische Option hin geprüft wird. Es konnte gezeigt werden, dass solche Zellen menschlicher Herkunft, in AAT-defizienten Mäusen angehen und menschliches Albumin bilden. Weitere Untersuchungen auf ihre Fähigkeit zur AAT-Bildung müssen abgewartet werden. 25
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
- Biochim Biophys Acta Gen Subj. 2018 Sep;1862(9):1852-1861. DOI: 10.1016/j.bbagen.2018.05.017[↩]
- Sci Transl Med. 2014 Jan 1;6(217):217ra1. DOI: 10.1126/scitranslmed.3007116. [↩]
- Int J Mol Sci. 2022 Feb 23;23(5):2441. DOI: 10.3390/ijms23052441.[↩]
- Methods Mol Biol. 2017;1639:1-8. doi: 10.1007/978-1-4939-7163-3_1. PMID: 28752441.[↩][↩]
- Transl Gastroenterol Hepatol. 2021 Apr 5;6:23. DOI: 10.21037/tgh.2020.02.23. [↩]
- Curr Gastroenterol Rep. 2014 Jan;16(1):367[↩]
- Transl Gastroenterol Hepatol. 2021 Apr 5;6:23. DOI: 10.21037/tgh.2020.02.23.[↩][↩]
- Eur Respir Rev. 2020 Feb 12;29(155):190073. DOI: 10.1183/16000617.0073-2019.[↩][↩]
- Aliment Pharmacol Ther. 2018 Apr;47(7):877-885. doi: 10.1111/apt.14537. [↩]
- F1000Res. 2017 Nov 27;6:2049. doi: 10.12688/f1000research.12399.1[↩][↩]
- Int J Environ Res Public Health. 2020 Mar 29;17(7):2294. DOI: 10.3390/ijerph17072294. [↩]
- Eur Respir Rev. 2015 Mar;24(135):46-51. doi: 10.1183/09059180.10010714.[↩]
- Int J Chron Obstruct Pulmon Dis. 2018 Jan 31;13:419-432. doi: 10.2147/COPD.S149429[↩]
- Lancet. 2015 Jul 25; 386(9991):360-8.[↩]
- Lancet Respir Med. 2017 Jan; 5(1):51-60.[↩]
- Aliment Pharmacol Ther. 2018 Apr;47(7):877-885. doi: 10.1111/apt.14537. Epub 2018 Feb 15. PMID: 29446109.[↩]
- J Thorac Dis. 2019 Apr;11(4):1130-1144. DOI: 10.21037/jtd.2019.04.40. [↩]
- Respir Med Case Rep. 2020 Nov 26;31:101309. doi: 10.1016/j.rmcr.2020.101309[↩]
- Ther Adv Chronic Dis. 2021 Jul 29;12_suppl:20406223211002988. DOI: 10.1177/20406223211002988. [↩]
- Dig Liver Dis. 2021 May;53(5):606-611. DOI: 10.1016/j.dld.2020.10.016.[↩]
- Am J Respir Cell Mol Biol. 2020 Nov;63(5):560-570. doi: 10.1165/rcmb.2020-0159PS.[↩]
- Expert Opin Biol Ther. 2014 Nov 3:1-8[↩]
- Expert Opin Biol Ther. 2015 Mar;15(3):329-36. doi: 10.1517/14712598.2015.978854.[↩]
- Am J Respir Cell Mol Biol. 2020 Jul 15. DOI: 10.1111/apt.14537 . Epub ahead of print. PMID: 32668173.[↩]
- Am J Transl Res. 2021 Apr 15;13(4):2710-2716. PMCID: PMC8129336[↩]